Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
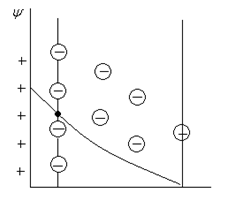
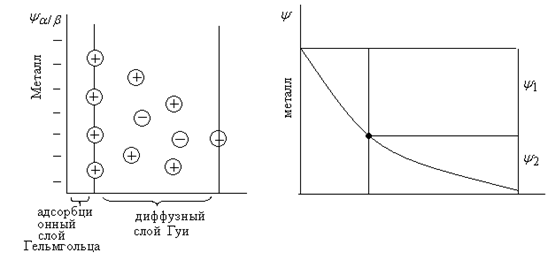
Строение ДЭС на границе раствор-металлДвойной электрический слой создается электрическими зарядами, находящимися на металле ионами противоположного заряда (противоионами), ориентированными у поверхности электрода. Формулирование ионной обкладки ДЭС происходит за счет электростатических сил и сил теплового движения, за счет последних сил ДЭС приобретает размытое диффузное строение. В создании ДЭС существенная роль принадлежит специфической абсорбции ионов. Под строением ДЭС понимают распределение зарядов в его ионной обкладке. (Гельмгольц, Штерн, Фрумкин). ДЭС состоит из двух частей: 1) Плотная или гельмгольцевская часть, образованная ионами, плотно подошедшими к поверхности металла (10-8см); 2) Диффузная часть, созданная ионами, находящимися от металла на расстоянии большем радиуса сольватированного иона (10-7-10-3см). Рассмотрим пример: Проводник I рода (Cu) поместили в раствор CuSO4 (проводник II рода).
При равновесии Рассмотрим два случая: 1) В этом случае ионы металла из твердого тела (проводника I р.) будут переходить в раствор до тех пор, пока: Поверхность металла заряжается отрицательно. ψ – потенциал на границе металл - раствор ψ1 – падение потенциала в плотном слое ψ2 – падение потенциала в диффузной части. ДЭС представляет собой как бы обкладку конденсатора.
2) ДЭС возникает всегда на границе: проводник I рода – проводник II рода. В целом ДЭС электронейтрален, его толщина зависит от концентрации раствора, заряда металла и температуры. В концентрированных растворах диффузная часть практически отсутствует.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 393. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
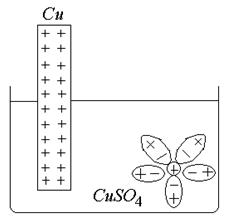 Металл: в узлах кристаллической решетки находятся ионы меди, расположенные упорядоченно. В растворе электролита и у поверхности ионы Cu2+ покрыты сольватной оболочкой из молекул воды.
Металл: в узлах кристаллической решетки находятся ионы меди, расположенные упорядоченно. В растворе электролита и у поверхности ионы Cu2+ покрыты сольватной оболочкой из молекул воды.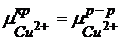
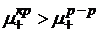 , т.е. химический потенциал катиона в кристаллической решетке больше химического потенциала катиона в растворе.
, т.е. химический потенциал катиона в кристаллической решетке больше химического потенциала катиона в растворе.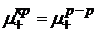 .
.
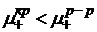 Ионы из раствора переходят на поверхность металла, заряжая ее положительно.
Ионы из раствора переходят на поверхность металла, заряжая ее положительно.