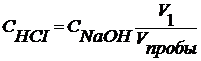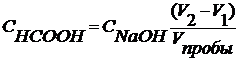Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Влияние природы растворителя на предельную подвижность ионовТоль в водных растворах и спиртах сохраняется высокая подвижность ионов H+ (протонов), а OH- в воде. При взаимодействии HCI со спиртом образуется катион этоксоний (общее название меоксоний):
Этоксоний HCI + H2O = H3O+ + CI- гидроксоний Эстафетный механизм передачи протона вдоль цепочки молекул растворителя сохраняется и в спиртах. Подвижность ионов в различных растворителях зависит от диэлектрической проницаемости растворителя. Чем выше диэлектрическая проницаемость (ε) растворителя, тем выше степень диссоциации электролита и электрическая проводимость раствора. Зависимость молярной электропроводности ионов от вида растворителя.
Зависимость молярная электрическая проводимость HCI от диэлектрической проводимости растворителя (t=250C, p=1атм.)
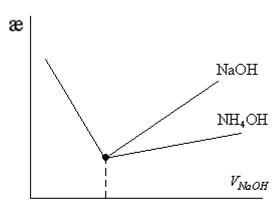
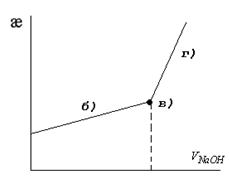
Кондуктометрический метод анализа При кондуктометрическом титровании растворов электролитов точка эквивалентности определятся по излому кривой зависимости электрической проводимости титруемого раствора от количества титранта. Резкое изменение электрической проводимости происходит при образовании в процессе титрования малодиссоциируемых и трудно растворимых соединений. Электрохимические методы титрования более точные.  Титрование сильной кислоты щелочью
б) При добавлении NaOH H3O+ + OH- = 2H2O количество ионов H3O+ уменьшается, электропроводность снижается до точки эквивалентности.
в) В точке эквивалентности нет ионов H3O+ и OH-, есть только ионы Na+ и CI, самая низкая электропроводимость. г) После точки эквивалентности накапливаются гидроксид ионы (OH-) электропроводимость опять возрастает.
Если вместо NaOH взять любую щелочь (NH4OH), α =10-2, то линия после точки эвтектики пойдет ниже NH4OH ⇆ NH4+ + OH- NH4OH + H3O+ = 2H2O + NH4+
Титрование слабой кислоты щелочью Муравьиная кислота – HCOOH HCOOH + NaOH ⇆ H3O+ + HCOONa + H2O а) HCOOH + H2O ⇆ H3O+ + HCOO- - плохая диссоциация - плохая электропроводность. б) HCOOH + Na+ + OH- = H2O + HCOO- + Na+ - слабое возрастание электропроводимости за счет Na+ и СH3COO- в) в точке эквивалентности г) NaOH избыток, возрастание электропроводимости за счет и OH- - ионов.
Титрование смеси двух кислот Вначале титруется сильная кислота, а затем слабая кислота. Например, смесь HCI + HCOOH . V1 – объем, пошедший на титрование HCI
СNaOH V1 = Vпробы CHCI
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 372. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 HCI + C2H5OH = C2H5OH2+ +CI-
HCI + C2H5OH = C2H5OH2+ +CI-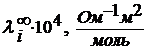
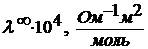
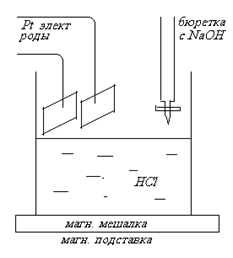 а) При растворении в воде HCI диссоциирует HCI + H2O ⇆ H3O+ + CI- подвижность H3O+ больше в 7 раз подвижностей остальных ионов, æ=æmax (λ=λmax)
а) При растворении в воде HCI диссоциирует HCI + H2O ⇆ H3O+ + CI- подвижность H3O+ больше в 7 раз подвижностей остальных ионов, æ=æmax (λ=λmax)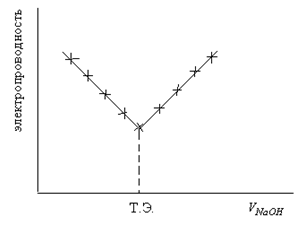
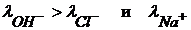
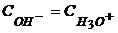
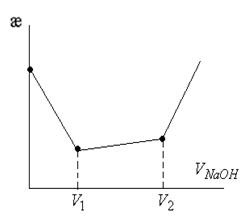 (V2‒V1) – объем щелочи, пошедший на титрование HCOOH.
(V2‒V1) – объем щелочи, пошедший на титрование HCOOH.