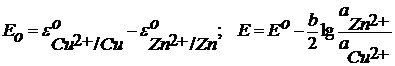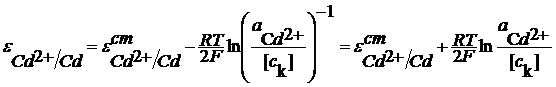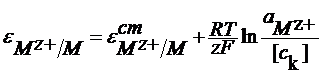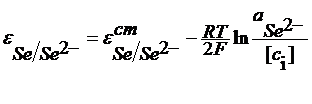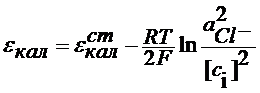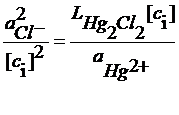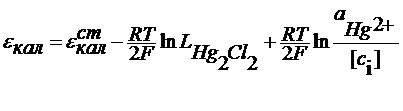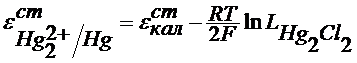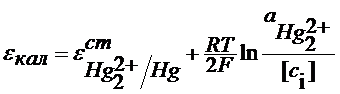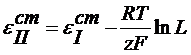Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Термодинамика гальванического элементаЛюбой самопроизвольный процесс, протекающий при постоянном давлении и температуре, сопровождается уменьшением энергии Гиббса, которое равно максимально полезной работе, электрической работе.
По уравнению Гиббса-Гельмгольца
Величины Z и F ≠ f (Т), тогда
где Из уравнения (2.54) можно вычислить тепловой эффект реакции.
Изменение энтропии в ходе процесса:
Измерение ЭДС гальванического элемента можно проводить компенсационным методом при любой температуре. С увеличением температуры ЭДС увеличивается нелинейно.
Электрическая работа больше теплового эффекта реакции.
Может быть
Вывод уравнения Нернста для расчета ЭДС Гальванического элемента
Изменение энергии Гиббса в ходе химического процесса:
Для газовых электродов:
Тогда Изменение энергии Гиббса в ходе электрохимической реакции
Это постоянная величина при заданных давлении и температуре, она называется стандартная ЭДС гальванического элемента – Е0 и определяется только природой реакции.
Исходя из изотермы химической реакции, можно записать выражение для Е0: 
Исходя из этого, можно записать уравнение Нернста для определения ЭДС гальванического элемента:
R, T, F не зависят от природы реакции, вводится сonst:
При Т=298 К (250С) При 293 К Выражение для расчета ЭДС примет вид:
Для гальванического элемента Даниэля-Якоби: Zn – 2e = Zn2+ (Окисление) Cu2+ + 2e = Cu0 (восстановление) Zn + Cu2+ = Cu0 + Zn2+
Классификация электродов Электрод - это часть гальванического элемента, сочетание проводника 1 рода (металла) и проводника 2 рода(электролита). Электроды классифицируются по виду компонентов, участвующих в электродной реакции. Электроды первого рода В электродной реакции участвуют металлы и их катионы или металлоиды и их анионы. Электроды 1 рода состоят из металлов, погруженных в раствор их растворимой соли или металлоидов в растворе, содержащих их анионы. Например: Ag | AgNO3; Cd | CdSO4. Сd2+ +2e =Cd
Или в общем виде:
У этих электродов в реакции участвуют катионы и потенциал этих электродов зависит от активности катионов. Такие электроды называют электродами обратимыми по катиону. Другой пример электродов первого рода: Se/Se2- Se + 2e = Se2-
В электродной реакции участвуют анионы и потенциал электрода зависит от активности аниона - это электроды, обратимые относительно аниона. Электроды второго рода В электродной реакции участвуют металлы, их труднорастворимые соединения и анионы труднорастворимых соединений. Электроды 2 рода состоят из металла, его труднорастворимого соединения и электролита, содержащего анионы труднорастворимого соединения. Например, хлорсеребряный электрод Ag | AgClТВ | KCl Или каломельный электрод (каломель - это Hg2Cl2)
Hg | Hg2Cl2тв |NaCl Hg2Cl2тв+2e = 2Hg + 2Cl-
В растворе над осадком Hg2Cl2
С учетом последнего уравнения
Из сказанного следует, что потенциал электрода 2 рода можно представить и как функцию анионов и как функцию катионов ,т.е. они являются обратимыми по катиону и по аниону. При этом стандартный условный электродный потенциал электрода второго рода связан со стандартным условным электродным потенциалом соответствующего электрода первого рода:
где z - заряд катиона труднорастворимого соединения. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 399. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
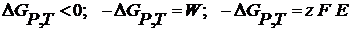 (2.3)
(2.3)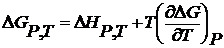 (2.4)
(2.4)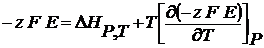
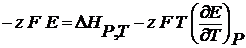 (2.5)
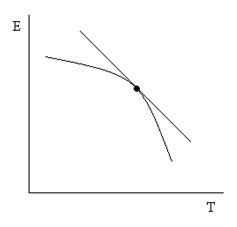
(2.5)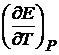 – есть температурный коэффициент Е гальванического элемента, который показывает, как изменяется ЭДС при изменении температуры.
– есть температурный коэффициент Е гальванического элемента, который показывает, как изменяется ЭДС при изменении температуры.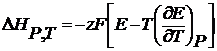 (2.6)
(2.6)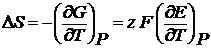 (2.7)
(2.7)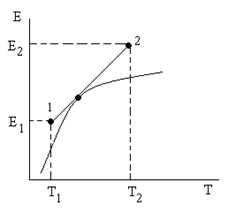
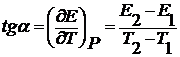 (2.8)
(2.8)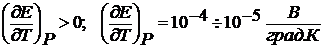
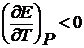 , тогда электрическая работа меньше
, тогда электрическая работа меньше 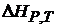
 Значения
Значения 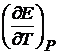 даются в справочниках, но можно определить и экспериментально.
даются в справочниках, но можно определить и экспериментально.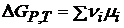
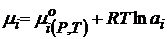 (чаще всего концентрация в С - шкале).
(чаще всего концентрация в С - шкале).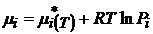
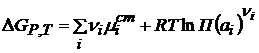
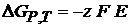
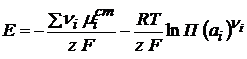 (2.9)
(2.9)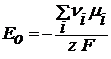 (2.10)
(2.10)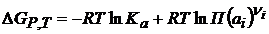
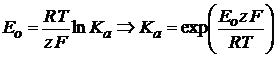 (2.11)
(2.11)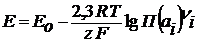 (2.12)
(2.12)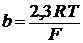 (2.13)
(2.13)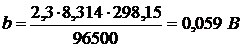
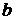 =0,058
=0,058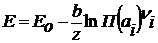 (2.14)
(2.14)