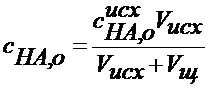Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение констант кислотности слабых кислотМетодом рН-метрии Измерения проводят в разбавленных растворах, принимая коэффициент активности равным единице. Если не учитывать реакцию автопротолиза воды, то уравнение ионных равновесий в водном растворе слабой одноосновной кислоты будет иметь следующий вид: HA + H2O = H3O+ + A- x Константа кислотности выразится как:
Если кислота слабая, то
Отсюда получаем
Готовят растворы с разной начальной концентрацией кислоты и измеряют их рН. Строят график зависимости рН от lg cHA . Из вышеприведенного уравнения следует, что отрезок, отсекаемый прямой на оси ординат равен 1/2рKкис.
Определение константы кислотности потенциометрическим методом Для одноосновной кислоты
Для определения Для получения более точных результатов проводят титрование раствора слабой кислоты раствором NaOH, в ходе титрования измеряют величину ЭДС элемента и рассчитывают рН. В системе протекают следующие реакции: H2O + H2O = H3O+ + OH- x1 HA + H2O = H3O+ + A- x2 H3O+ + NaOH = 2 H2O + Na x3 Можно допустить, что x1 << x2 и x1 << x3 . Балансовые уравнения имеют вид:
Как было показано ранее
Отсюда:
РАЗДЕЛ 3. КИНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ПРОСТЫХ РЕАКЦИЙ Химическая кинетика – это наука, изучающая протекание химической реакции или физико – химических процессов во времени, это раздел физической химии, в котором изучается зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды, излучения и других факторов.  Химическая кинетика позволяет рассчитать время заданной степени превращения вещества и найти наиболее эффективные факторы воздействия на скорость химической реакции.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 365. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
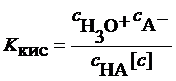 причем [c] = 1 моль/л
причем [c] = 1 моль/л


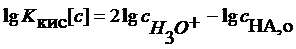


 .
.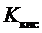 надо измерить концентрацию ионов гидроксония в растворе с известной концентрацией кислоты. В качестве индикаторного электрода можно использовать стеклянный или хингидронный электрод , например Ag | AgCl | KCl || H3O+, нас.х.г |Pt
надо измерить концентрацию ионов гидроксония в растворе с известной концентрацией кислоты. В качестве индикаторного электрода можно использовать стеклянный или хингидронный электрод , например Ag | AgCl | KCl || H3O+, нас.х.г |Pt
 ;
; .
.