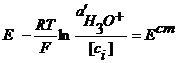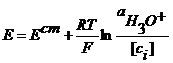Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Окислительно-восстановительные электродыВ электродной реакции участвуют ионы разной степени окисления. О-В электроды состоят из инертного металла, обычно платины и раствора, содержащего ионы разной степени окисления. Например, Pt| Fe2+, Fe3+ ; Pt |Sn2+ , Sn4+ . Sn4+ + 2e = Sn2+
В общем виде:
z- число электронов, участвующих в ОВ реакции. Газовые электроды Это электроды, у которых в электродной реакции участвует вещество в газообразном состоянии и его ионы, находящиеся в растворе. Например, водородный электрод 2H3O+ +2e = H2+2H2O
Если давление водорода 1 атм, то Хлорный электрод Pt (Cl2) | Cl- Cl2 + 2e = 2Cl-
При давлении газообразного хлора 1 атм:
Классификация гальванических элементов По источнику ЭДС гальванические элементы делятся на химические и концентрационные. В химических ГЭ источником ЭДС является химическая реакция. В концентрационных ГЭ ЭДС возникает за счет разной концентрации ионов в растворах и вещества на электродах. И химические и концентрационные ГЭ по наличию или отсутствию диффузионной разности потенциалов ( Пример1. Ag | AgClТВ |KCl || KCl | (Cl2) Pt Ag – e + Cl- = AgClТВ Cl2 + 2e = 2Cl- 2 Ag + Cl2+ 2Cl-(лев) = 2AgClтв + 2Cl-(прав)
В элементе ЭДС возникает за счет химической реакции и ее величина зависит от активности компонентов, участвующих в ней. В элементе имеется граница раздела между двумя электролитами KCl. Следовательно данный элемент относится к химическим элементам с переносом. Пример 2 Но если оба электрода поместить в один электролит, то получим элемент Ag | AgClТВ |KCl | (Cl2) Pt Ag – e + Cl- = AgClТВ Cl2 + 2e = 2Cl- 2 Ag + Cl2 = 2AgClтв
В этом элементе нет границы раздела между электролитами, это химический элемент без переноса.  Пример 3. Zn | ZnSO4 || ZnSO4 | Zn Zn – 2e = Zn2+ Zn2+ +2e = Zn (Zn2+)пр + Zn = (Zn2+)лев + Zn
В общем случае
Элемент состоит из одинаковых электродов, различаются только концентрации ионов Zn2+ в растворах - это концентрационный элемент с переносом.
Пример 4 Pt (H2) | HCl (водный раствор) | (H2) Pt H2 - 2 e + 2H2O = 2H3O+ 2H3O+ + 2e = H2 +2H2O (H2)лев = (H2)прав
Это концентрационный элемент без переноса.
Потенциометрический метод анализа (ПМА) ПМА основан на зависимости условного электродного потенциала от активности определяемых ионов. В ПМА используются элементы, состоящие из индикаторного электрода и электрода сравнения. Индикаторный электрод - это электрод, потенциал которого зависит от активности определяемых ионов. Электрод сравнения - это обычно электрод второго рода, потенциал которого остается постоянным в ходе эксперимента. Измерение рН растворов Индикаторный электрод - это электрод, потенциал которого зависит от активности ионов гидроксония. Это могут быть: а) водородный электрод б) хингидронный электрод в) стеклянный электрод. Рассмотрим подробнее случаи б) и в) б). Индикатоный электрод - хингидронный. Pt | H3O+, нас. хингидроном Это окислительно-восстановительный электрод. Хингидрон: C6H4O2× C6H4(OH)2 = C6H4O2+C6H4(OH)2 C6H4O2 + 2e = 2H3O+ = C6H4(OH)2+2H2O
В кислых средах
Ag | AgCl | KCl || H3O+, нас.х.г |Pt
Отсюда:
У этого электрода есть и преимущества и недостатки. В) индикаторный электрод - стеклянный электрод. В состав стекла входят ионы щелочных металлов.
На поверх. В растворе в растворе на поверхн. стекла стекла
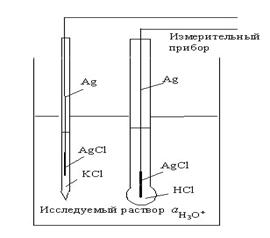
Элемент для измерения рН Ag | AgCl |KCl || исследуемый раствор, H3O+ HCl |AgCl|Ag
Приборы для измерения ЭДС этого элемента, а, следовательно, и величины рН, называются рН-метры.
Шкала прибора градуируется в единицах рН с помощью буферных растворов. рН-метр удобен в работе. Позволяет измерять рН в широких пределах. На показания прибора не влияют примеси окислителей и восстановителей. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 398. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
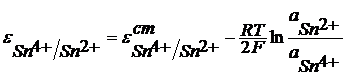
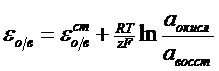
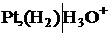
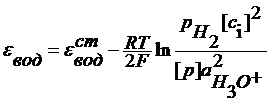
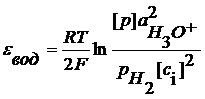
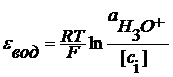
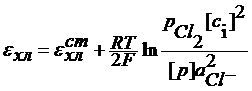
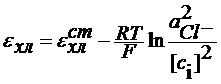
 ) делятся на элементы с переносом и элементы без переноса.
) делятся на элементы с переносом и элементы без переноса.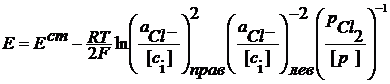
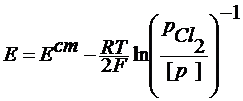
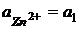
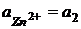
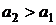
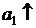
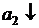
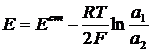
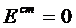
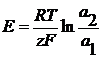
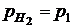
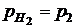
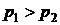
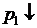
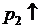
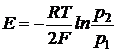 или
или 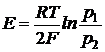
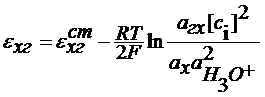
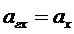
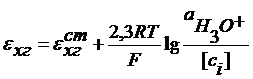
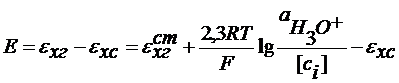
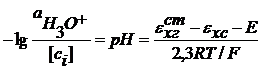
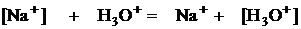

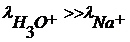 , поэтому поверхность стекла получает избыточный положительный заряд. Образуется скачок потенциала на границе фаз «стекло- раствор». Его величина зависит от концентрации ионов гидроксония в растворе.
, поэтому поверхность стекла получает избыточный положительный заряд. Образуется скачок потенциала на границе фаз «стекло- раствор». Его величина зависит от концентрации ионов гидроксония в растворе.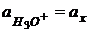
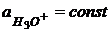
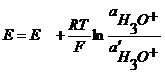
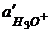 - это активность ионов гидроксония в стеклянном электроде.
- это активность ионов гидроксония в стеклянном электроде.