
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Титрование смеси кислоты и солиСмесь: H2SO4 + CuSO4 Первый участок титрования: H2SO4 + 2NaOH V1 – объем пошедший на титрование H2SO4 H3O++SO42-+2Na++2OH-=2Na++SO42-+2H2O Второй участок титрования: CuSO4+2NaOH→Cu(OH)2+2Na++SO42- Электропроводность практически не меняется, т.к. ионы (Cu2++SO42-) заменяются на (2Na++SO42-). Третий участок титрования: накопление гидроксид ионов, электропроводность возрастает.
Кислотно-основная теория Бренстеда Теория Аррениуса широко применяется к трактовке различных кислотно-основных равновесий или протолитических равновесий. Согласно этой теории кислотой (НА) является соединение, диссоциирующее на протоны Н+ и кислотный остаток: НА ⇆ Н+ + А−, а основанием является соединение, диссоциирующее на катионы металла и ионы гидроксила: ВОН ⇆ В+ + ОН- Более широкую практику кислотно-основных равновесий дает теория Бренстеда. Согласно этой теории кислота – донор протона, основание − акцептор протона. При протолитическом равновесии образуются кислотно-основные пары. Например, в реакции (диссоциация) HCI + H2O ⇆ H3O+ + CI- молекула HCI – кислота, H2O – основание. В определенных условиях ион Н3О+ может отдать CI- - иону протон. В этом случае H3O+ - кислота, а ион CI- - основание, сопряженное с HCI. Н3О+ + CI- → HCI + H2O Одно и тоже вещество в определенных условиях может проявлять кислотные или основные свойства. Например, уксусная кислота является кислотой по отношению к воде и основанием по отношению к более сильной серной кислоте, принимая от нее протон.  Диссоциация воды. Ионное произведение воды Вода – это довольно слабый электролит. Рассмотрим диссоциацию воды: Н2О + Н2О ⇆ Н3О+ + ОН- С0−х х х С0(1-α) С0 α С0 α
По уравнению Дебая – Хюккеля
С→0; Ионная сила воды
− это ионное произведение воды.
Константа диссоциации Н2О при 18°С = 1,1∙10-16
Кw – безразмерная величина. Расчет
Ионное произведение Н2О зависит от температуры, т.к. сильно изменяется диэлектрическая проницаемость воды. Зависимость ионного произведения воды от температуры
Кw25=1∙10-14 [в шкале моль/л] Кw25=1∙10-8 [в шкале моль/м3] В чистой воде Зоренсоном был введен водородный показатель рН как
От значений Кw рассчитывается шкала рН. рН=7 – нейтральная среда рН<7; рН>7; Несмотря на использование системы СИ при определении рН используется концентрация в [моль/л].
РАЗДЕЛ 2. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ |
||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 397. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
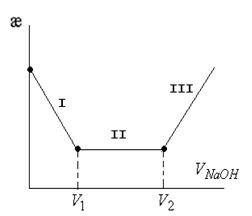 Кондуктометрическое титрование широко применяется при титровании мутных и окрашенных растворов, где обычным объемным методом титрования сложно по изменению окраски в присутствии индикаторов определить точку эквивалентности, а также для титрования многокомпонентных смесей.
Кондуктометрическое титрование широко применяется при титровании мутных и окрашенных растворов, где обычным объемным методом титрования сложно по изменению окраски в присутствии индикаторов определить точку эквивалентности, а также для титрования многокомпонентных смесей.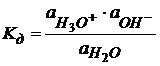 (1.45)
(1.45)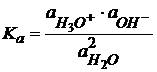 (1.46)
(1.46)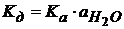
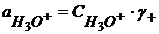
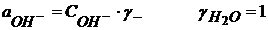
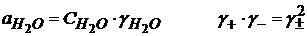
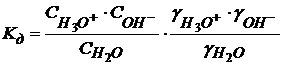 (1.47)
(1.47)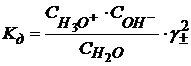
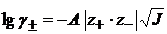
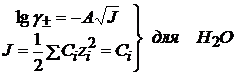
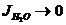 , т.е.
, т.е. 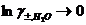 , таким образом Кд определяется концентрацией Н2О.
, таким образом Кд определяется концентрацией Н2О.
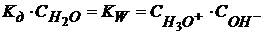 (1.48)
(1.48)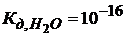
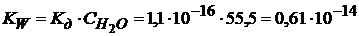
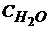 : 1л Н2О (ρ =999 кг/м3)
: 1л Н2О (ρ =999 кг/м3)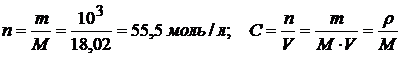
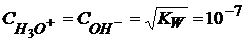 моль/л
моль/л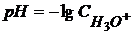 (1.49)
(1.49)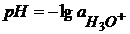
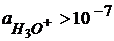 – кислая среда
– кислая среда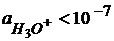 – щелочная среда
– щелочная среда