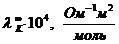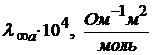Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Молярная электрическая проводимостьМолярная электрическая проводимость − эта мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при расстоянии 1м между параллельными электродами. Для одновалентных электролитов мольная электропроводимость (λ) равна эквивалентной электропроводимости (λэ). Для 1−2 валентных электролитов Для 1−3 валентных электролитов Между молярной и удельной электрической проводимостью имеется соотношение
где: λ – молярная электрическая проводимость V – разведение раствора, м3/моль с – концентрация, моль/м3. Если концентрация раствора выражена в моль/л, то
С учетом, что
Значение молярной электропроводимости зависит от концентрации электролита. На рисунке представлена зависимость молярной электрической проводимости от концентрации для сильных (1) и слабых (2) электролитов. С увеличением разведения молярная электропроводимость возрастает и в области больших разведений стремится к предельному значению
Произведение Тогда
Гипотетический бесконечно разбавленный раствор характеризуется полной диссоциацией электролита и отсутствием электростатических сил. λ ∞ − это сумма двух независимых слагаемых. Закон независимого движения ионов Кольрауша:
 λ ∞ иона=f(Т, природа иона и растворителя) Соотношение
где В разбавленных растворах
Для сильных электролитов, когда α = 1
Теория электролитической проводимости растворов Дебая − Онзагера: Снижение молярной электрической проводимости при переходе от разбавленных растворов к концентрированным растворам связано с уменьшением скорости движения ионов за счет: 1) эффекта электрофоретического торможения, обусловленного электростатическим взаимодействием между ионом и его ионной сферой; 2) эффектом релаксационного торможения (нарушение симметрии иона). По теории Онзагера
где А и В – константы, полученные с учетом сил релаксационного и электрофоретического торможения.
Зависимость молярной электропроводимости от температуры Изменение электропроводимости раствора проводят в термостате, т.к. она в сильной степени зависит от температуры. Это связано: 1. С изменением вязкости среды (стоксовское сопротивление среды движению ионов). С увеличением температуры вязкость уменьшается, скорость иона возрастает. 2. С уменьшением степени гидратации (сольватации) ионов с повышением Т, при этом увеличивается подвижность ионов. 3. В области 70-1000С резко уменьшается диэлектрическая постоянная воды, → резко уменьшается диссоциация воды а, следовательно, и электропроводимость.
где V – разведение электролита (V=1/c)
Молярная электрическая проводимость ионов Гидроксония и гидроксида В водных растворах протон (ион) водорода записывают в виде иона гидроксония – H3O+ H+ + H2O ⇆ H3O+ Ионы H3O+ и гидроксида OH− обладают более высокой молярной электрической проводимостью или подвижностью, чем другие ионы. Подвижности большинства катионов и анионов лежат в пределах (40-80) 10-4 Значение предельной подвижности иона гидроксония 1. При наложении электрического поля переход протона от H3O+ к молекуле воды повышается в направлении поля. Передвижение протона совершается по цепочке от одной молекулы воды к другой по схеме:
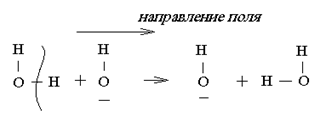
Электричество переносится мигрирующими ионами H3O+ и протонами. 2. Аналогичным образом объясняется подвижность ионов гидроксида. Протон переходит от молекулы воды к иону гидроксида
Так как энергия отрыва протона от молекулы воды больше, чем от иона гидроксония, то вероятность перехода протона от H2O к OH− меньше, чем от Н3O+ к воде. Поэтому При одном и том же заряде иона с увеличением радиуса иона увеличивается подвижность иона, так как на поверхности иона уменьшается плотность заряда, уменьшается степень его гидратации и эффективный радиус иона. Предельные подвижности некоторых ионов Р = 1 атм, t = 25°С
При одном и том же заряде иона с увеличением радиуса иона увеличивается подвижность иона, так как на поверхности иона уменьшается плотность заряда, уменьшается степень его гидратации и эффективный радиус иона.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 458. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
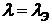
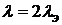 , (CdCI2, H2SO4).
, (CdCI2, H2SO4).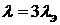 .
.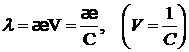 (1.34)
(1.34) ,
,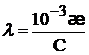 (1.35)
(1.35)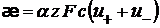 , следует
, следует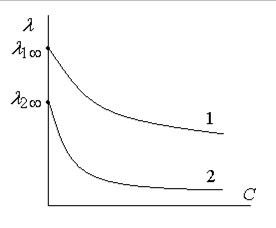
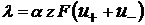 (1.36)
(1.36)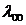 , тогда
, тогда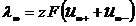 (1.37)
(1.37)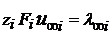 называется предельной электрической проводимостью ионов (
называется предельной электрической проводимостью ионов ( 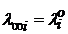 − иногда обозначают так).
− иногда обозначают так).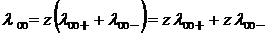 (1.38)
(1.38)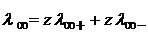 (1.39)
(1.39)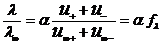 , (1.40)
, (1.40)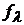 – коэффициент электрической проводимости.
– коэффициент электрической проводимости.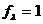 , отсюда
, отсюда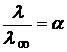 (1.41)
(1.41)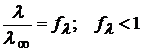 (1.42)
(1.42)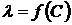 ; для 1,1 – валентного электролита
; для 1,1 – валентного электролита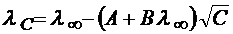 (1.43)
(1.43)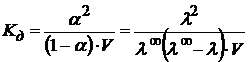 (1.44)
(1.44)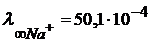
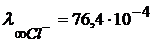
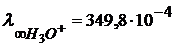
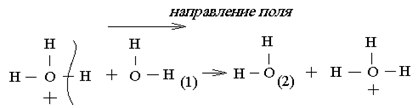
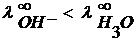 .
.