
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Термодинамическая константа диссоциацииРастворов электролитов Константа равновесия любого химического процесса, в том числе и диссоциации, выраженная через активность, записывается следующим образом:
Из уравнения изотермы химической реакции активность иона Для примера рассмотрим диссоциацию одноосновной кислоты в водном растворе: HA + H2O ⇆ H3O+ + A- Протон Н+ в природе не существует, в водных растворах он всегда гидратирован молекулами и существует в виде иона гидроксония.
Обычно в растворах С0,1≫С0,2, т.е. концентрация растворителя значительно больше концентрации растворенного вещества.
Кдисс включает в себя произведение Кравн. на активность воды.
Перегруппируем
Активности катиона и аниона определить невозможно; активность молекулярной формы принято считать равной единице. Тогда
Известно, что
Для одноосновной кислоты
С учетом этого
Кс – концентрационная константа диссоциации, которая зависит от С, Т и природы растворителя. Выразим Кс через степень электролитической диссоциации α: НА + Н2О ⇆ Н3О+ + А⁻
Степень диссоциации электролита
Отсюда
Это уравнение является законом разведения Оствальда. Значение константы Кс можно определить экспериментальным путем по значению α:
λ ∞ рассчитывают по уравнению Кольрауша:
 Прологарифмируем уравнение (2.44)
Значение
Для НА
или
Рассчитав ионную силу раствора и экспериментально определив Kc, можно найти величину Кдисс.
Кдисс.=f (Т,Р, природа растворителя) Kc =f (Р,Т,С, природа растворителя), т.е. Кдисс.≠ f(C) В справочниках приводятся значения рК=−lg Кдисс.
Для кислот – рКa (или рКА) Для оснований рКв (или рКВ) рКА или рКВ – показатель константы диссоциации кислоты и основания.
Если рК = 9÷16 – очень слабые электролиты, рК = 3÷9 – слабые электролиты, рК ≤ 3 – умеренно слабые электролиты.
Механизм переноса тока в растворах электролитов. Числа переноса В растворе электролита сольватированные ионы находятся в беспорядочном тепловом движении. При наложении электрического поля возникает упорядоченное движение ионов к противоположно заряженным электродам – миграция (перенос).
Е – приложенное напряжение постоянного тока, В, h – расстояние между электродами, Vi – скорость иона , Чем выше приложенное напряжение Е, тем быстрее двигается ион; чем больше расстояние между электродами, тем меньше скорость движения иона. Под скоростью движения иона Vi понимают расстояние, которое проходит ион в единицу времени в направлении одного из электродов
Абсолютная скорость движения (подвижность) ионов ui не зависит от Е и h и определяется соотношением
Абсолютная скорость иона определяется природой иона, температурой и не зависит от условий проведения процесса
Произведение
Каждый вид иона переносит определенное количество электричества. Для оценки доли участия данного вида иона в переносе электричества Гитторфом введено понятие о числе переноса. Число переноса иона i – вида – это отношение количества электричества, перенесенного ионом данного вида, к общему количеству электричества
Можно найти значение чисел переноса иона как отношение
Сумма чисел переноса всех видов ионов в растворе равна 1.
Поэтому для расчетов достаточно задать одно значение числа переноса и рассчитать другое значение.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 390. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
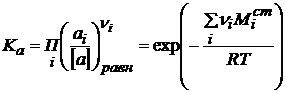 (1.12)
(1.12)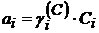 .
. 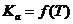 .
.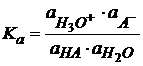 (1.13)
(1.13)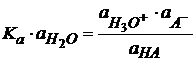 (1.14)
(1.14)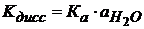
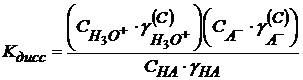 (1.15)
(1.15)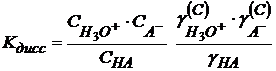 (1.16)
(1.16)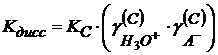 (1.17)
(1.17)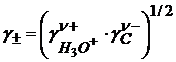
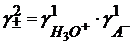
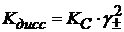 (1.18)
(1.18)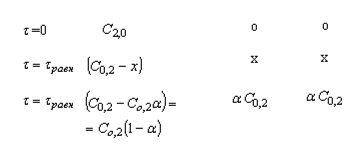
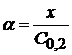
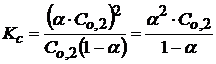
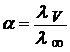
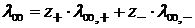
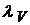 определяется кондуктометрическим методом.
определяется кондуктометрическим методом.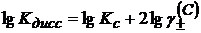 (1.19)
(1.19)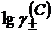 определяют по уравнению Дебая-Хюккеля:
определяют по уравнению Дебая-Хюккеля: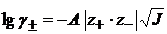
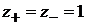 , тогда
, тогда 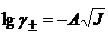
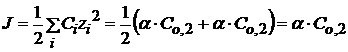
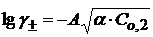
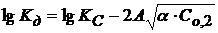
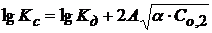
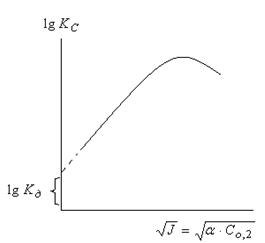 Найденная константа Кдисс. экстраполирована на нулевую точку, при которой J =0
Найденная константа Кдисс. экстраполирована на нулевую точку, при которой J =0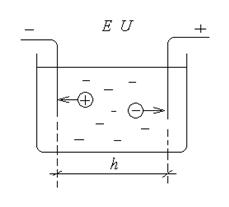
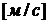 .
.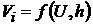 (1.20)
(1.20)
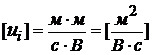
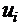 на число Фарадея называется подвижностью иона – λi.
на число Фарадея называется подвижностью иона – λi.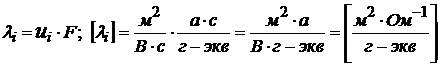
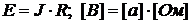
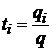 (1.21)
(1.21)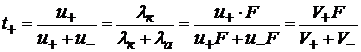 (1.22)
(1.22)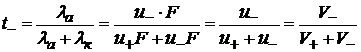 (1.23)
(1.23)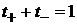 (1.24)
(1.24)