
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Сильные и слабые электролитыЭлектролитами называют вещества, которые в растворе или расплаве самопроизвольно частично или полностью распадаются на ионы, способные к самостоятельному существованию. Раствор электролита электронейтрален. Число ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита при соблюдении закона электронейтральности. Например: NaCI ⇆ Na+ + CI- CuSO4 ⇆ Cu2+ + SO42- CaCI2 ⇆ Ca2+ + 2CI- По способности к диссоциации электролиты разделяются на сильные и слабые. К сильным электролитам принадлежат сильные кислоты, сильные основания и большинство солей. В растворах различной концентрации сильные электролиты практически полностью диссоциированы на ионы (KOH, NaOH, H2SO4, NaCI, K2SO4). К слабым электролитам относят слабые кислоты (H2SO4, H3PO4, CH3COOH), слабые основания (NH4OH) и некоторые соли (HgCI2). Процесс диссоциации слабых электролитов обратим, ионы противоположного знака в растворе соединяются в молекулы. Слабые электролиты распадаются на ионы лишь частично.
Диссоциация молекулы электролита под действием полярных молекул растворителя Сольватация ионов – это образование связей между ионом и молекулами растворителя. Электролитическая диссоциация в растворе Теория электролитической диссоциации Аррениуса. Закон разведения Оствальда Процесс распада растворенного вещества в растворе на ионы называется электролитической диссоциацией. Первая количественная теория растворов электролитов (теория электролитической диссоциации) была высказана Аррениусом. По этой теории молекулы кислот, оснований и солей при растворении распадаются на противоположно заряженные ионы. Процесс диссоциации электролитов обратим, происходит образование молекулы из ионов, т.е. в растворе существуют ионы и молекулы. Равновесие между ионами и молекулами подчиняется закону действующих масс.  Для электролита AB, диссоциирующего в растворе на ионы по схеме AB ⇆ A+ + B− выражение для константы диссоциации имеет вид
В состоянии равновесия доля молекул, распавшихся на ионы, характеризует степень диссоциации электролита 1. природы растворителя; 2. концентрации электролита; 3. температуры; 4. присутствия других растворителей. С учетом степени диссоциации равновесные концентрации частиц будут равны
Тогда
− это уравнение называется законом разведения Оствальда и описывает поведение слабых электролитов. При малых значениях
Kдисс = f (T, природы растворителя), но не зависит от концентрации электролита в растворе. Свойства растворов электролитов существенно отличаются от свойств идеальных растворов. Это объясняется увеличением числа частиц в растворе электролита за счет диссоциации и электролитическим взаимодействием между ними. Вант-Гофф обнаружил увеличение осмотического давления в растворах электролитов
где i– изотонический коэффициент Вант – Гоффа (i >1) c– концентрация в моль/л В водных растворах NaCI i ≈2, в BaCI2 ~3 – он (i) показывает приближенно число ионов, на которые диссоциируют молекулы электролита. Для слабых электролитов, при диссоциации которых образуется ν ионов
i связан со степенью диссоциации Отклонение свойств реальных растворов от свойств идеальных растворов учитывается с помощью коэффициентов активности, а концентрацию слабых электролитов заменяют на активность
Ka – термодинамическая константа диссоциации. Ионы в растворах электролитов сольватированы молекулами растворителя, поэтому при написании выражений для константы диссоциации необходимо учитывать и молекулы растворителя. Например: HA – слабый электролит, органическая кислота в водном растворе, тогда диссоциация идет по уравнению HA + H2O ⇆ H₃O⁺ +A– H3O+ – ион гидроксония
Процесс ионизации (или диссоциации) одноосновной кислоты правильно будет представить совокупностью двух уравнений
Вклад реакции (Б) в общее изменение концентрации H3O+ невелик, им можно пренебречь. Тогда
Значение Ka при 298 K это справочная величина. Сложнее обстоит дело с диссоциацией двухосновных кислот (H2S, H2CO3, H2SO3 и т.д.) Обозначим их общей формулой H2A При установлении протолитического равновесия справедливы следующие реакции: H2A + H2O → H3O+ + HA– (A) HA– + H2O → H3O+ + A2- (Б) H2O + H2O → H3O+ + OH– (B) Вклад реакции (В) в общее изменение концентрации невелик. При ионизации кислот по первой ступени
а по второй ступени
Таким образом, в растворе в равновесном состоянии одновременно могут находиться недиссоциированная кислота H2A и ионы: HA– и A2-. Уравнение материального баланса по аниону имеет следующий вид:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 367. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
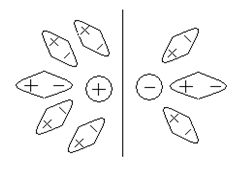 По современным представлениям ионы в растворе гидратируемы или сольватируемы, т.е. окружены определенным числом ориентированных диполей растворителя.
По современным представлениям ионы в растворе гидратируемы или сольватируемы, т.е. окружены определенным числом ориентированных диполей растворителя.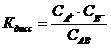 (1.5)
(1.5)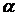 , которая зависит от:
, которая зависит от: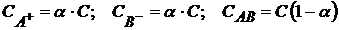
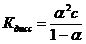 (1.6)
(1.6)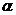 можно принять, что
можно принять, что 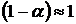 , тогда
, тогда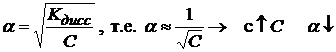 (1.7)
(1.7)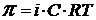 (1.8)
(1.8)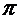 – осмотическое давление
– осмотическое давление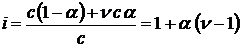 (1.9)
(1.9)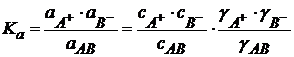 (1.10)
(1.10)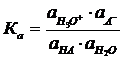 (1.11)
(1.11)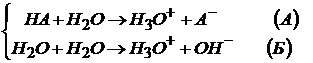
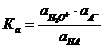 или для идеальных разбавленных растворов
или для идеальных разбавленных растворов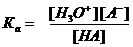 , где [H3O⁺], [A-], [HA] - равновесные концентрации.
, где [H3O⁺], [A-], [HA] - равновесные концентрации.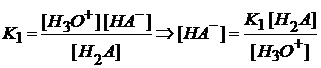 ,
,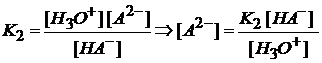
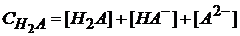 .
.