
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Растворы электролитов и их свойстваСтр 1 из 15Следующая ⇒ НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ В СЛОЖНЫХ ХИМИЧЕСКИХ ПРОЦЕССАХ Конспект лекций для студентов, обучающихся по программе бакалавриата по направлению подготовки 240100 – Химическая технология
Екатеринбург 2015 Содержание ВВЕДЕНИЕ 4 РАЗДЕЛ 1. ТЕРМОДИНАМИКА РАСТВОРОВ ЭЛЕКТРОЛИТОВ И ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМ 5 1.1. Общие понятия об электрохимических системах 5 1.2. Проводники электрических зарядов 5 1.3. Электролиз. Законы Фарадея 5 1.4. Растворы электролитов и их свойства 7 1.5.Электролитическая диссоциация в растворе 8 1.5.1.Теория электролитической диссоциации Аррениуса. Закон разведения Оствальда 8 1.5.2. Термодинамическая константа диссоциации растворов электролитов 11 1.6. Механизм переноса тока в растворах электролитов. Числа переноса 13  1.7. Удельная и эквивалентная электрические проводимости растворов электролитов 14 1.8. Молярная электрическая проводимость 16 1.9. Зависимость молярной электропроводимости от температуры 18 1.10. Молярная электрическая проводимость ионов гидроксония и гидроксида 18 1.11. Влияние природы растворителя на предельную подвижность ионов 19 1.12. Кондуктометрический метод анализа 20 1.13. Диссоциация воды. Ионное произведение воды 25 РАЗДЕЛ 2. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ 27 2.1. ЭДС электрохимической системы. Электродный потенциал 27 2.2. Строение ДЭС на границе раствор-металл 28 2.3. Устройство и изображение гальванического элемента 29 2.4. Термодинамика гальванического элемента 31
2.5. Вывод уравнения Нернста для расчета ЭДС гальванического элемента 32 2.6. Классификация электродов 33 2.7. Классификация гальванических элементов 36 2.8.Потенциометрический метод анализа (ПМА) 38 РАЗДЕЛ 3. КИНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ПРОСТЫХ РЕАКЦИЙ 43 3.1. Классификация химических реакций 43 3.2. Элементарные химические реакции 44 3.3. Скорость химической реакции 44 3.4. Кинетические кривые и кинетические уравнения 45 3.5. Молекулярность и порядок реакции 46 3.6. Элементарный акт химического превращения. Теория переходного состояния или активированного комплекса 48 3.7. Интегральные и дифференциальные уравнения реакций с целочисленными порядками реакций 49 3.7.1. Реакции нулевого порядка 49 3.7.2. Односторонние (необратимые) реакции I порядка 51 3.7.3. Односторонние реакции II порядка 53 3.7.4. Односторонние реакции nго порядка 55 3.7.5. Методы определения порядка реакции 56 3.8. Зависимость скорости химической реакции от температуры. Уравнение Аррениуса 58 РАЗДЕЛ 4. КИНЕТИКА СЛОЖНЫХ ГОМОГЕННЫХ И ГЕТЕРОГЕННЫХ РЕАКЦИЙ. КАТАЛИТИЧЕСКИЕ РЕАКЦИИ 60 4.1. Мономолекулярные обратимые (двусторонние) реакции первого порядка 60 4.2. Мономолекулярные параллельные односторонние реакции 62 4.3. Мономолекулярные односторонние последовательные реакции 63 4.4. Основные понятия кинетики гетерогенных реакций 66 4.5. Интегральное кинетическое уравнение для расчета константы гетерогенной реакции 69 4.6. Катализ. Специфичность, селективность катализа 70 4.6.1. Свойства катализаторов 71 4.6.2.Каталитическая активность и избирательность 74 4.6.3. Кислотно-основной катализ 75 4.7. Гетерогенный катализ. Теории гетерогенного катализа 79 Рекомендуемая литература 84
ВВЕДЕНИЕ Основными целями учебной дисциплины «Неравновесные процессы в сложных химических процессах» является изучение и объяснение закономерностей, определяющих временные характеристики химических процессов, скорость их протекания, влияние на них параметров окружающей среды, условия получения максимального выхода продукта. Эта дисциплина формирует творческое инженерное мышление студентов, стремится к количественному описанию химических процессов, используя такие фундаментальные методы исследования как термодинамический, квантово – химический, статистический, поэтому для успешного усвоения кинетических закономерностей химических превращений студент должен владеть основами физики и высшей математики, а также иметь твердые знания по неорганической и органической химии. Электрохимия – это раздел физической химии, в котором изучаются законы взаимного превращения химической и электрической формы энергии и систем, где эти превращения совершаются. Электрические системы и явления рассматриваются в равновесных условиях в отсутствии электрического тока и в неравновесных при прохождении электрического тока. Знание физико – химических закономерностей протекания химических реакций во времени открывает перед инженером широкие возможности для понимания функционирования экологических систем, разработки новых технологических процессов, удовлетворяющих современным требованиям экологической безопасности, для разработки методов и средств, необходимых для создания автоматизированных систем мониторинга окружающей среды. Преподавание физической химии неравновесных процессов имеет цель дать студенту тот фундамент, с помощью которого можно провести количественный анализ любого физико-химического процесса.
РАЗДЕЛ 1. ТЕРМОДИНАМИКА РАСТВОРОВ ЭЛЕКТРОЛИТОВ И ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМ Общие понятия об электрохимических системах Электрохимия – это раздел физической химии, в котором изучаются законы взаимного превращения химической и электрической формы энергии и систем, где эти превращения совершаются. Электрические системы и явления рассматриваются в равновесных условиях в отсутствии электрического тока и в неравновесных при прохождении электрического тока. В разделе электрохимии изучаются физико-химические свойства ионных проводников, процессы и явления на границе раздела фаз с участием заряженных частиц – ионов и электронов. Электрохимия, как наука, возникла на рубеже 18-19 веков на основании трудов Л. Гальвани, А. Вольта, В. Петрова, Г. Деви и М. Фарадея. Электрохимия имеет большое практическое значение, а именно: электролиз в металлургии легких и цветных металлов, химическая промышленность, технология гальванотехники, коррозия и защита металлов.
Проводники электрических зарядов Проводники электрического тока делятся на электронные, или проводники I рода, и ионные – проводники II рода. Проводники I рода: передача электричества осуществляется движением электронов электронного газа. К ним относятся металлы в твердом и расправленных состояниях. К проводникам II рода принадлежат растворы солей, кислот и оснований, и соли в расплавленном состоянии. Передача электричества осуществляется в них движением положительных и отрицательных ионов. Существуют вещества, обладающие смешанной проводимостью.
Электролиз. Законы Фарадея Взаимное превращение электрической м химической энергии происходит в электрохимических системах, состоящих из следующих частей: 1. Проводники II рода; 2. Проводники I рода – металлические электроды. Положительный электрод называется анодом, отрицательный – катодом. 3. Проводники I рода – внешняя электрическая цепь, связывающая электроды. Электролиз – это химическое превращение в электрической системе под действием внешнего электрического поля. При электролизе отрицательные ионы движутся к аноду (+) – анионы. Положительно заряженные частицы – катионы – двигаются к катоду. Вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов называются электролитами. Представим систему, в которой имеется раствор медного купороса (CuSO4 + H2O). При растворении в воде электролита происходит диссоциация на ионы CuSO4 ⇆ Сu2+ + SO42- При погружении в раствор электродов (катода и анода) начинается направленное движение ионов. На катоде происходит восстановление меди по реакции: Cu2+ + 2e → Cu0 и выделяется на нем металлическая медь. Соотношение между (количеством) массой прореагировавших веществ и количеством постоянного электрического выражается законами Фарадея. Первый закон Фарадея: Масса вещества m претерпевшего химическое превращение под действием электрического тока пропорциональна количеству протекшего электрического тока.
где: m – масса вещества; J – сила тока; τ – время электролиза Kэ – электрохимический эквивалент.
Второй закон Фарадея: При прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в реакциях, пропорциональны их химическим эквивалентам. Для выделения 1 г–экв. любого вещества требуется пропустить 1 Фарадей электричества. 1 Фарадей = 1F = 96500 Кл
Э – химический эквивалент, M – мольная масса вещества; z – число
тогда II закон Фарадея дает физический смысл Kэ: Кэ – это количество вещества, которое претерпевает превращение при пропускании через раствор 1 Кл электричества. На практике часто наблюдается отклонение от законов Фарадея вследствие протекания побочных реакций; а именно: 1). в электролитах, содержащих кислоты, происходит дополнительно восстановление водорода (кислота увеличивает электропроводность) Например: электролит ZnSO4 + H2SO4 на катоде(−): Zn2+ + 2e → Zn0 – основная 2Н+ + 2е →H2 ↑– побочная 2). Неполное восстановление металла на катоде: Fe3+ + 3e→ Fe0 Fe3+ + 1e→ Fe2+ 3). Наличие нескольких реакций восстановления на катоде: Au3+ + 3e→ Au0 – основная Au1+ + 1e→ Au0 - побочная 4). Взаимодействие продуктов электролиза с электролитом: H2O + NaCl H2O ⇆ H+ + OH- Ионы щелочных металлов не восстанавливаются, на катоде идет восстановление водорода: (−) 2H2+ + 2e = H2↑ В прикатодном пространстве накапливаются ионы натрия, в прианодном - ионы гидроксила На аноде идет окисление CI— ионов: (+) 2CI− − 2e →CI2↑ выделяется газ. Образующаяся NaOH взаимодействует с CI2: 2NaOH + CI2 = NaCI + NaCIO + H2O Эффективность электрохимического процесса оценивается величиной выхода по току
В отсутствии побочных процессов ψ =1, но на самом деле ψ < 1.
Растворы электролитов и их свойства |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 355. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
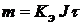 , где
, где 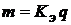 (1.1)
(1.1)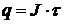 – количество электричества.
– количество электричества.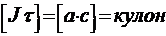
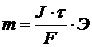 (1.2)
(1.2)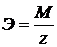 ;
; , принимающих участие в электродной реакции.
, принимающих участие в электродной реакции.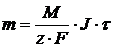 , (1.3)
, (1.3)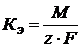 – электрохимический эквивалент
– электрохимический эквивалент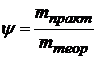 (1.4)
(1.4)