Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Свойства и функции коферментов
Коферменты относятся к сложным органическим веществам, их молекулы значительно меньше по размеру, чем молекулы ферментов. Коферменты могут проникать через биологические мембраны, нагревание обычно не вызывает изменения их структуры. Кофермент, локализуясь в каталитическом участке активного центра фермента, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. В ходе реакции кофермент претерпевает химические превращения, в точности противоположные тем, которые происходят в субстрате. Например, в окислительно-восстановительных реакциях молекула субстрата окисляется, а молекула кофермента восстанавливается. При последующих сопряжённых реакциях изменения в коферменте протекают в обратном направлении, и он воспроизводится в первоначальной форме.
Таким образом, кофермент является одним из субстратов ферментативной реакции, т.е. выступает как косубстрат. По происхождению и химическому строению коферменты можно подразделить на следующие группы: - Производные витаминов (Е, К, Q, С, Н, В1, В2, В6, В12 и др); - Соединения нуклеотидной природы (NAD, NADP, АТP, CоА, FAD, FMN); - Гемы (простетические группы цитохромов, пероксидаз); - Убихинон, иликоэнзим Q(перенос электронов и протонов в дыхательной - цепи электронов); - Липоевая кислота; - Фосфоаденозилфосфосульфат (участвует в переносе сульфата); - S-аденозилметионин (SАМ) – донор метильной группы); - Глутатион (трипептид γ–глутамил-цистеинил-глицин участвует в окислительно-восстановительных реакциях). Небелковая часть сложного фермента может быть представлена также ионами металлов (Mg2+, K+, Mn2+, Ca2+, Zn2+, Cu2+ и др.). Ферменты, содержащие в своем составе ионы металлов, называются металлоферментами. Например, α-амилаза включает ионы Са2+, которые участвуют в стабилизации пространственной структуры фермента. Удаление этих ионов приводит к потере активности фермента. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТP, а комплекс Mg2+, АТP. В этом случае ион Mg2+, не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТP и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента. 
Специфичность ферментов Способность фермента катализировать определенный тип реакции называют специфичностью. Структура активного центра фермента комплементарна структуре его субстрата. Поэтому фермент из всех имеющихся в клетке веществ выбирает и присоединяет только свой субстрат. Для ферментов характерна специфичность не только по отношению к субстрату, но и в отношении пути его превращения. У ферментов различают абсолютную, относительную (групповую) и стереохимическую специфичность. Абсолютная специфичность – избирательная способность фермента катализировать только единственное из возможных превращений одного субстрата. Это можно объяснить конформационной и электростатической комплементарностью молекул субстрата и фермента. Например, фермент аргиназа катализирует только гидролиз аминокислоты аргинина, фермент уреаза – только расщепление мочевины и не действуют на другие субстраты. Относительная специфичность (группоспецифичность) – избирательная способность фермента катализировать однотипные превращения сходных по строению субстратов. Такие ферменты оказывают воздействие на одинаковые функциональные группы или на один и тот же тип связей в молекулах субстратов. Так, например, разные гидролитические ферменты действуют на определённый тип связей: амилаза – на гликозидные связи; пепсин и трипсин – на пептидные связи; липаза и фосфолипаза – на сложноэфирные связи. Действие этих ферментов распространяется на большое число субстратов, что позволяет организму обойтись малым количеством пищеварительных ферментов. Стереохимическая (оптическая) специфичность – избирательная способность фермента катализировать превращение только одного из возможных пространственных изомеров субстрата. Так, большинство ферментов млекопитающих катализирует превращение только L-изомеров аминокислот, но не D-изомеров. Ферменты, участвующие в обмене моносахаридов, наоборот, катализируют превращение только D-, но не L-фосфосахаров. Гликозидазы специфичны не только к моносахаридному фрагменту, но и характеру гликозидной связи. Например, α-амилаза расщепляет α-1,4-гликозидные связи в молекуле крахмала, но не действует на α-1,2-гликозидные связи в молекуле сахарозы.
Изоферменты
Изоферменты (изозимы) – множественные формы ферментов, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по аминокислотному составу, первичной структуре, электрофоретической подвижности, локализации в клетке и органе, сродству к субстрату, кинетическим свойствам. Они выполняют одинаковые биологические функции, но с различной эффективностью, могут присутствовать в разных тканях одного организма, в разных типах клеток одной ткани и даже в одной клетке прокариотического организма, например, в клетках E. coli. Изоферменты играют регуляторную роль в обмене веществ и позволяют метаболизму в разных тканях лучше приспосабливаться к действию внутренних и внешних факторов. Примером фермента, у которого были обнаружены такие формы, может служить лактатдегидрогеназа, катализирующая обратимое восстановление пирувата в лактат, в которой в роли восстановителя выступает NADH. Лактатдегидрогеназа (ЛДГ) присутствует в тканях животных и человека в виде пяти разных изоферментов, которые различаются на уровне четвертичной структуры. Молекула ЛДГ состоит из четырех протомеров двух типов, Н (от англ. heart – сердце) и М (от англ. muscle – мышца), которые различаются по аминокислотному составу и последовательности аминокислот. Каталитической активностью обладает только тетрамерная молекула. Пять изоферментов ЛДГ имеют следующий полипептидный состав: ЛДГ1 – (Н4); ЛДГ2 – (Н3М); ЛДГ3 – (Н2М2); ЛДГ4 – (НМ3); ЛДГ5 – (М4) (Рис. 4.1).
Рисунок 4.1 – Субъединичный состав (а) и распределение в клетках и органах изоформ лактатдегидрогеназы (б).
Различные ткани человека имеют свои характерные изоферментные спектры. В сердечной мышце и почках наиболее высокой активностью обладают изоферменты ЛДГ1 и ЛДГ2. В печени и скелетной мускулатуре максимальны ЛДГ5. В селезенке, поджелудочной железе, щитовидной железе, надпочечниках – ЛДГ3. В тканях, в которых преобладает аэробный распад глюкозы, присутствуют обычно ЛДГ1 и ЛДГ2, для которых характерно низкое сродство к пирувату. Поэтому они не могут эффективно конкурировать за пировиноградную кислоту с пируватдегидрогеназным комплексом. В результате пируват подвергается преимущественно окислительному декарбоксилированию и образующийся в этой реакции ацетил-CоА «сгорает» в цикле трикарбоновых кислот. В тканях, где доминирует анаэробный гликолиз, присутствуют изоферменты с высоким сродством к пирувату: ЛДГ4 и ЛДГ5. В них пируват расходуется преимущественно в лактатдегидрогеназной реакции.
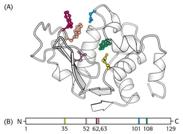
Активные центры ферментов Участок молекулы фермента, который предназначен для специфического связывания субстрата, называется активным центром. Активный центр – это уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное его взаимодействие с молекулой субстрата и принимающая прямое участие в акте катализа. У сложных ферментов в состав активного центра входит также кофактор. В активном центре условно различают каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом и участок связывания, который обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. Несмотря на огромное разнообразие структуры ферментов, их специфичности и механизма действия, существует ряд общих закономерностей формирования активных центров: 1) на активный центр приходится относительно малая часть объёма фермента (5-10 аминокислотных остатков). Роль остальных аминокислот, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную конформацию для оптимального протекания химической реакции; 2) активный центр – это сложная трёхмерная структура, в образовании которой принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка (рис. 5.1). Поэтому при воздействии физических и химических факторов, вызывающих денатурацию (нагревание, концентрированные кислоты и щёлочи) утрачивается конформация активного центра и фермент теряет свою активность;
Рисунок 5.1 – Аминокислотные остатки, образующие активный центр лизоцима (А) принимают участие во взаимодействии с субстратом. Схематическое представление первичной структуры лизоцима показывает, что активный центр фермента построен из аминокислотных остатков, которые в полипептидной цепи расположены далеко друг от друга (В).
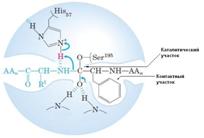
3) активный центр имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата и катализа; 4) в составе активного центра можно условно выделить две части: а) контактный или якорный участок, где происходит связывание субстрата в нужной ориентации; б) каталитический участок, обеспечивающий протекание реакции. Четкую грань между каталитическим и субстратным центром провести можно не всегда – у некоторых ферментов они совпадают или перекрываются (Рис. 5.2).
Рисунок 5.2 – Структура активного центра химотрипсина. Показаны принципиально важные для катализа остатки Ser195 и His 57.
5) размеры ферментов намного превышают размеры их низкомолекулярных субстратов; 6) субстраты относительно слабо связываются с ферментами. В связывании и превращении субстрата принимают участие следующие группировки аминокислотных радикалов: - полярные заряженные: карбоксильные группы глутамата и аспартата, аминогруппы лизина; гуанидиновые группы аргинина; имидазольные группы гистидина; - полярные незаряженные: гидроксильные группы серина и треонина; сульфгидрильные группы цистеина; фенольные группы тирозина; - неполярные группы: углеводородные цепи алифатических аминокислот; ароматические кольца фенилаланина и триптофана. У сложных ферментов в формировании активных центров принимают участие также функциональные группы коферментов. В образовании фермент-субстратных комплексов принимают участие такие же взаимодействия, как и те, что обеспечивают формирование пространственной структуры макромолекул, межклеточных контактов и других процессов в биологических системах: - водородные связи между полярными незаряженными группировками субстрата и фермента; - ионные связи между противоположно заряженными группировками субстрата и фермента; - гидрофобные взаимодействия между неполярными группировками субстрата и фермента. Эти три основных типа нековалентных взаимодействий различаются по своей геометрии, энергии, специфичности.
|
|||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 329. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |