Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Уровни структурной организации белковых молекулСтр 1 из 38Следующая ⇒ Практикум по Биохимии
Минск 2017 Содержание
Теоретическая Часть
Аминокислоты
Аминокислоты как основные составные части белков участвуют во всех жизненных процессах наряду с нуклеиновыми кислотами, углеводами и липидами. Кроме аминокислот, входящих в состав белков, живые организмы обладают постоянным резервом «свободных» аминокислот, содержащихся в тканях и в клеточном соке. Данные молекулы используются в синтезе множества биологически активных соединений, к которым относятся нейромедиаторы и гормоны, обеспечивающие регуляцию процессов обмена веществ в организме. Аминокислоты служат донорами атомов азота при синтезе всех небелковых азотсодержащих соединений, в том числе нуклеотидов, гема, креатина, холина и других веществ. Аминокислоты и их производные входят в состав коферментов, желчных кислот, антибиотиков. Различают протеиногенные и непротеиногенные аминокислоты.  Аминокислоты, которые в соответствии с генетическим кодом включаются в состав белков в процессе трансляции, называются протеиногенными. В состав белков входят 20*протеиногенных аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется содержанием и последовательностью расположения входящих в них аминокислот. Последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка. Аминокислоты, которые нередко обнаруживаются в белках, но не имеют кодовых слов и не включаются в белки в процессе трансляции, называются непротеиногенными. Обнаружение таких аминокислот в белках объясняется протеканием реакций модифицирования данных биомолекул пост-трансляционно или, например, рацемизацией аминокислот в составе белков (см. далее). Непротеиногенные аминокислоты могут образовываться в качестве промежуточных продуктов при биосинтезе и деградации протеиногенных аминокислот, а также других органических молекул.
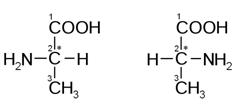
Строение аминокислот. Аминокислоты являются аминопроизводными класса карбоновых кислот. Основные функциональные группы аминокислот представлены амино- и карбоксильными группами которые связаны с одним и тем же a-атомом углеродного скелета аминокислоты (Рис. 1.1). Между собой аминокислоты различаются только строением боковых цепей (R–группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде.
*Недавно была открыта 21-ая протеиногенная аминокислота – селеноцистеин. При физиологических значениях рН аминокислоты в растворах находятся преимущественно в виде биполярных ионов (обычно используемая запись строения a-аминокислоты в неионизированном виде служит лишь для удобства).
Рисунок 1.1 – Общая структурная формула a-аминокислот.
Стереоизомерия аминокислот.Это свойство связано с наличием в молекуле всех природных аминокислот (за исключением глицина) в a-положении асимметрического атома углерода (хирального центра), все четыре валентные связи которого заняты различными заместителями. Аминокислоты cущeствуют в виде двух зеркальных изомеров (Рис. 1.2) или энантиомеров: L- и D-aминoкиcлoт.
Рисунок 1.2 – Модели асимметрических молекул аланина. а – тетраэдрическая модель, б – модель Кекуле.
Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода (Рис. 1.3). Два возможных его стереоизомера принято обозначать буквами L и D.
Рисунок 1.3 – Стерическое соответствие между структурой энантиомеров аланина и абсолютной конфигурацией L- и D-глицеральдегида.
Стереоизомеры всех хиральных соединений, соответствующие по конфигурации L-глицеральдегиду, обозначаются буквой L, а стереоизомеры, соответствующие D-глицеральдегиду – буквой D. Все пpотeиногенныe аминoкиcлoты oтноcятcя к L-ряду. D-Аминoкиcлоты вcтpeчaютcя во многих природных пептидах, продуцируемых микроорганизмами, например в антибиотиках (грамицидин, актиномицин, полимиксин), а также в составе биополимеров клеточной стенки бактерий. Среди протеиногенных аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Для них возможно существование четырёх стереоизомеров. Например, у треонина, помимо L- и D-треонина, имеется ещё два стереоизомера, которые называются диастереоизомерами или аллоформами: L-алло-треонин и D-алло-треонин (Рис. 1.4).
Рисунок 1.4 – Структурные конфигурации стереоизомеров треонина.
Чистые L- или D-стереоизомеры могут со временем самопроизвольно и неферментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,10 % в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого. Физические свойства.Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они хорошо растворяются в воде, аммиаке и других полярных растворителях, в неполярных и слабополярных растворителях (этанол, метанол, ацетон) растворяются плохо. Причиной такого поведения является легкий переход незаряженной молекулы в цвиттерион, который связан с выигрышем свободной энергии. Кислотно-основные свойства.Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), то есть каждая аминокислота содержит как минимум одну кислотную (–СООН) и одну основную (–NH2) группы. В растворе эти группы находятся в двух формах, заряженной и незаряженной, между которыми поддерживается протонное равновесие: R–COOH и R–NH3+ являются протонированными партнерами, то есть кислотами (донорами протонов), а R–COO¯ и R–NH2 – сопряженными основаниями (акцепторами протонов). Поэтому в водной среде a-аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы (Рис. 1.5):
Рисунок 1.5 – Ионные формы аминокислот.
Соотношение между этими формами, то есть заряд молекул аминокислот в растворе зависит от рН среды (Рис. 1.6). Изменение рН в кислую среду приводит к подавлению диссоциации кислотных групп. Поэтому в сильнокислой среде аминокислоты существуют преимущественно в виде катионов (приобретают положительный заряд). Напротив, изменение рН в щелочную среду, вызывает отщепление протонов от основных функциональных групп. Поэтому в сильнощелочной среде аминокислоты существуют преимущественно в виде анионов.
Рисунок 1.6 – Изменение суммарного заряда аминокислот (гистидина и глутамата) в зависимости от рН среды.
При нейтральных значениях рН все кислотные и все основные функциональные группы аминокислот находятся в диссоциированном состоянии. Поэтому нейтральные аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд и существуют в виде биполярного иона (цвиттериона). Кислые аминокислоты содержат две карбоксильные группы, которые диссоциируют, отдавая два протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты и раствор их имеет кислую реакцию. Сам ион аминокислоты заряжается отрицательно. Основные аминокислоты реагируют в водном растворе как слабые основания, так как один протон, который освобождается при диссоциации карбоксильной группы, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, в результате увеличивается количество OH– групп и повышается pH среды. Заряд иона таких аминокислот в нейтральной среде будет положительным. При определенном значении pH наступает такое состояние, при котором заряд аминокислоты становится нейтральным (скомпенсированным). Значение рН, при котором суммарный заряд аминокислоты равен нулю и она не перемещается в постоянном электрическом поле, называется ее изоэлектрической точкой (рI). Таким образом, при значении pH = рI, аминокислоты не перемещаются в электрическом поле и обладают наименьшей растворимостью. Если pH < рI, катион аминокислоты движется к катоду, а при pH > рI, анион аминокислоты – к аноду. На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез). Изоэлектрическая точка кислых аминокислот находится в слабокислой среде, основных – в слабоосновной, а нейтральных – в нейтральной среде. Изоэлектрическая точка для нейтральных аминокислот рассчитывается по формуле:
рI = ½ (рК1 + рК2), где
рК1 – величина рК для a-карбоксильной группы, а рК2 — для a-аминогруппы. Изоэлектрическая точка для кислых и основных аминокислот рассчитывается по формуле: рI = ½ (рК1 + рКR), где
рКR – рК для ионизированной группы, находящейся в радикале. Кривые титрования аминокислот.Если регистрировать изменение рН раствора аминокислот при добавлении щелочи или кислоты, то получаются типичные кривые титрования аминокислот, зависящие от числа ионизированных групп (Рис. 1.7-1.9). Если радикалы аминокислот нейтральны, то они почти не оказывают влияния на диссоциацию a-карбоксильной группы или a-аминогруппы, и величины рК (то есть значения рН, при которых эти группы в среднем наполовину диссоциированы) остаются относительно постоянными. Вследствие этого кривые титрования почти всех нейтральных аминокислот накладываются друг на друга и могут быть рассмотрены на примере аланина (Рис. 1.7). В начале титрования (при значении pH < рК1) большинство молекул аланина находятся в полностью протонированной форме и в растворе преобладают ионы +NH3–CHR–COOH. При приближении значения рН к 2,34 (численно равном величине рК1 a-карбоксильной группы) происходит активная диссоциация протонов от a-карбоксильных групп, что при рН 2,34 приводит к присутствию в растворе в эквимолярных концентрациях ионов +NH3–CHR–COOH и +NH3–CHR–COO−. На этом участке кривой титрования наблюдается «плато»: добавление щелочи не приводит к существенному изменению рН раствора. Это связано с нейтрализацией вносимой щелочи активно высвобождающимися из аланина протонами. После участка «плато» в растворе начинают преобладать молекулы аминокислоты с депротонированной a-карбоксильной группой и при дальнейшем титровании при рН 6,01 (точка перегиба кривой) молекулы аланина достигают изоэлектрической точки, то есть находятся в виде биполярного иона (цвиттериона) +NH3–CHR–COO−. На второй стадии титрования, при приближении значения рН к 9,69 (численно равном величине рК2 аминогруппы) происходит диссоциация протона от a-аминогруппы аланина и при рН 9,69 в растворе присутствуют в эквимолярных концентрациях ионы +NH3–CHR–COO– и NH2–CHR–COO−. На этом участке кривой титрования наблюдается второе «плато», после чего в растворе начинает преобладать полностью депротонированная форма аминокислоты. Титрование завершается приблизительно при рН 12, когда практически все молекулы аланина находятся в форме полностью депротонированных ионов: NH2–CHR–COO−. Из кривой титрования аланина можно сделать вывод, что данная аминокислота проявляет буферные свойства в двух областях рН. Одна из них определяется сравнительно плоским участком кривой по обе стороны от точки, соответствующей рК1. Другая буферная зона расположена между значениями рН 8,7 и 10,7. Необходимо отметить, что при значении рН = 7,4, характерном для межклеточной жидкости и крови, аланин не проявляет буферные свойства.
Рисунок 1.7 – Кривая титрования 0,1 М раствора аланина 0,1 М раствором NaOH.
Аминокислоты, с диссоциирующими группами в радикале, имеют более сложные кривые титрования, складывающиеся из трех участков, соответствующих трем возможным стадиям ионизации (рис. 7 и 8), и следовательно, они имеют три значения рК (рК1, рК2, рКR). Изоэлектрические точки для таких аминокислот определяются типом присутствующей ионизируемой группы в радикале.
Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. При значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8), аминокислоты обладают буферными свойствами. Большое биологическое значение имеет поведение гистидина в качестве буфера. Это единственная аминокислота, которая обладает буферными свойствами в физиологической области рН. Спектральные свойства.Все аминокислоты поглощают свет в инфракрасной области спектра. Три ароматические аминокислоты (фенилаланин, тирозин и триптофан) поглощают свет в ультрафиолетовой области в диапазоне 260-290 нм (Рис. 1.10).
Рисунок 1.10 – Спектры поглощения ароматических аминокислот
Образование пептидных связей.Наиболее важной реакцией, в которой участвуют аминокислоты, является образование пептидных связей. При этом высвобождается одна молекула воды.
Равновесие реакции образования пептидной связи в обычных условиях сильно сдвинуто в сторону ее гидролиза. Поэтому для образования пептидных связей между аминокислотами их карбоксильные группы должны быть предварительно активированы. Химический синтез пептидов основан на предварительном получении хлорангидридов аминокислот. Биологическая активация аминокислот включает их взаимодействие с АТР. Пептиды
Пептиды – это природные или синтетические соединения, молекулы которых построены из остатков a-аминокислот, соединённых между собой пептидными связями. В зависимости от количества остатков аминокислот и молекулярной массы различают: низкомолекулярные пептиды (состоящие из двух – десяти остатков аминокислот – ди-, три-, тетра-, пентапептиды и так далее), пептиды со средней молекулярной массой (от 500 до 5000 дальтон, так называемые «средние молекулы») и высокомолекулярные пептиды (с молекулярной массой от 5000 до 16000 дальтон). Наиболее распространены линейные пептиды, однако известны также циклические пептиды, молекулы которых могут иметь различные размеры. В природе встречаются пептиды, построенные не только из аминокислот, но содержащие также оксикислоты, длинные остатки жирных кислот и другие компоненты. Поэтому различают гомомерные пептиды, состоящие исключительно из аминокислот и гетеромерные пептиды, которые кроме аминокислот содержат также небелковые компоненты. Пептиды широко распространены в природе. Они присутствуют во всех клеточных организмах (пептидный пул). Открытые и изученные в настоящее время пептиды можно разделить на группы по их основному физиологическому действию: - пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны гипоталамуса, меланоцитстимулирующий гормон, глюкагон, инсулин, и др.); - пептиды, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтестинальный пептид, желудочный ингибирующий пептид и др.); - пептиды, регулирующие тонус сосудов и артериальное давление (брадикинин, калидин, ангиотензин II); - пептиды, регулирующие аппетит (лептин, нейропептид Y, меланоцитстимулирующий гормон, β-эндорфины); - пептиды, обладающие обезболивающим действием (энкефалины и другие опиоидные пептиды); - пептиды, являющиеся токсичными веществами (аманитин, антибиотики, вырабатываемые некоторыми микроорганизмами); - пептиды, участвующие в регуляции высшей нервной деятельности, в биохимических процессах, связанных с механизмами сна, обучения, памяти, возникновения чувства страха и так далее. Однако такое деление пептидов крайне условно, так как многие из них обладают широким спектром действия.
Теоретическая часть
Белки
Белки – высокомолекулярные органические вещества, состоящие из остатков a-аминокислот, связанных между собой пептидными связями. Каждый белок характеризуется специфичной аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). Размер белка отражает его молекулярная масса, которая измеряется в дальтонах (Да) или, чаще, из-за относительно большой величины молекулы в производных единицах – килодальтонах (кДа).
Таблица 2.1 – Молекулярная масса наиболее известных белков.
По составу белки делят на простые и сложные. К простым белкам относят макромолекулы, состоящие только из аминокислот. Сложные белки включают неаминокислотные компоненты, такие как гем, производные витаминов, липиды, углеводы, атомы металлов и другие.
Простые белки
Универсальной системы классификации белков не существует, хотя имеется несколько общеупотребимых систем классификации, частично перекрывающихся между собой. Здесь мы рассмотрим основные принципы классификации белков, основанные на их растворимости, форме молекул, функциях, физических свойствах и особенностях трехмерной структуры.
Растворимость Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины, гистоны, альбумины, глобулины, проламины, глютелины (Таблица 2.2).
Таблица 2.2 – Растворимость наиболее известных типов белков.
Строго установленных границ между отдельными классами простых белков не существует. Например, четкое разграничение между альбуминами и глобулинами невозможно, если исходить только из их растворимости в воде и солевых растворах. Поэтому глобулины дополнительно подразделяют на псевдоглобулины, легко растворимые в воде, и эуглобулины, нерастворимые в воде, в отсутствие солей.
Форма молекул По форме молекул белки делят на глобулярные и фибриллярные (Рис. 2.1). Глобулярные белки – это белки, в молекулах которых полипептидные цепи плотно свернуты в компактные шарообразные структуры – глобулы (третичные структуры белка). Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями. К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции. В фибриллярных белках вытянутые полипептидные цепи расположены параллельно друг другу, образуя протяженные нити или слои. Большинство фибриллярных белков не растворяются в воде. К фибриллярным белкам относят: a-кератины – белки, входящие в состав волос, шерсти, перьев, рогов; коллаген – белок сухожилий и хрящей; фиброин – белок шёлка; актин, миозин и тубулин – внутриклеточные белки, участвующие в процессах мышечного сокращения и перемещения клеток. Большинство фибриллярных белков обладают особым свойством – в формировании их пространственной структуры, кроме слабых взаимодействий, принимают участие и ковалентные связи непептидной природы, тогда как в глобулярных белках основной вклад в стабилизацию конформации молекулы вносят слабые нековалентные взаимодействия.
Рисунок 2.1 – Фибриллярный белок коллаген (а), глобулярный белок миоглобин (б).
Функции Белки также классифицируют в соответствии с их биологическими функциями. К наиболее важным биологическим функциям можно отнести следующие: 1) Каталитическая функция, осуществляется белками-ферментами (трансферазы, гидролазы, изомеразы, лиазы и др.). Ферменты играют важнейшую роль во всех процессах жизнедеятельности, обеспечивая протекание большинства реакций катаболизма и анаболизма клетки и всего организма в целом, а также направляя и регулируя обмен веществ. 2) Структурная функция. Структурные белки отвечают за поддержание формы и стабильности клеток и тканей. Основными структурными белками межклеточного вещества являются фибриллярные белки. К структурным белкам относятся: · a-кератин – в основном из кератина состоят мертвые клетки ороговевающего эпителия и их производные (волосы млекопитающих, рога, копыта, когти, перья птиц, чешуя рептилий и др.). В живых клетках эпителиальных тканей кератины образуют промежуточные филаменты; · эластин – широко распространённый в соединительной ткани белок, особенно в коже, легких и кровеносных сосудах. В эластине большое количество аминокислотных остатков с неполярными боковыми группами, а также содержится аминокислота десмозин, являющаяся производным лизина. Данные особенности строения обусловливает высокую эластичность его волокон; · коллаген – белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и др.) и обеспечивающий ее прочность и эластичность; · белки цитоскелета. 3) Транспортная функция. Транспортные белки участвуют в переносе метаболитов, ионов, О2 и других веществ в кровяном русле, во внеклеточных тканевых жидкостях, а также в трансмембранном переносе веществ в клетки (Таблица 2.3)
Таблица 2.3 – Характеристика ряда белков-переносчиков.
4) Защитная функция. К защитным белкам относят, прежде всего, белки, участвующие в иммунной защите организма. К ним относятся иммуноглобулины, интерферон, лизоцим. К белкам, выполняющим функцию физической защиты организма можно отнести содержащиеся в плазме крови фибриноген (фибрин) и протромбин (тромбин) участвующие в процессах свертывания крови. 5) Двигательная функция присуща таким фибриллярным белкам как актин и миозин, участвующим в сокращении скелетных мышц Динеины и кинезины участвуют в энергозависимой транспортировке молекул и клеточных органелл вдоль микротрубочек. Динеины осуществляют перенос молекул и органоидов из периферических областей клетки по направлению к центросоме, кинезины действуют в противоположном направлении. Динеины также отвечают за движение ресничек и жгутиков эукариотических клеток. 6) Гормональная функция. Осуществляется такими белками, как инсулин, соматотропин (гормон роста), пролактин, тиреотропин, гонадотропин и другими. 7) Рецепторная функция. Указанная функция осуществляется белками-рецепторами, воспринимающими химические сигналы. Мембранные белки-рецепторы участвуют в трансдукции сигнала с поверхности клетки внутрь. Они регулируют функции клеток посредством изменения своей конформации в ответ на связывание сигнальной молекулы (лиганда), что приводит к активации ряда мембранных белков внутри клетки и синтезу так называемы вторичных посредников (месенджеров). 8) Регуляторная функция. Обеспечивается регуляторными белками, которые регулируют многие процессы внутри клеток (гистоны, белки-активаторы, белки-репрессоры и др.). 9) Резервная функция. В организме животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
Конформация белков
Для описания пространственной организации белковых молекул используется такое понятие, как конформация. Полипептидные цепи индивидуальных белков за счет взаимодействия функциональных групп аминокислот приобретают определенную пространственную трехмерную структуру, называемую конформацией. Конформационная лабильность белков – это способность этих биополимеров к небольшим изменениям трехмерной структуры за счет разрыва одних и образования других слабых связей и взаимодействий в пределах одной молекулы. Поскольку конформация белковой молекулы формируется при участии хотя и множества, но слабых взаимодействий различной природы, она обладает достаточной подвижностью так, что белок способен изменять ориентацию одной части молекулы относительно другой. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят друг в друга. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой молекулы. Эти обратимые конформационные переходы белков являются естественным физиологическим свойством данных биополимеров. Наиболее известной моделью, иллюстрирующей конформационные переходы в белках, является изменение состояния гемоглобина при его оксигенации/дезоксигенации. Уровни структурной организации белковых молекул Первичная структура белка
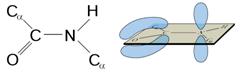
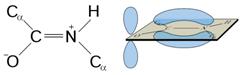
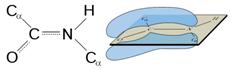
Под первичной структурой белков понимается длинная полипептидная цепь с характерной последовательностью аминокислот, соединенных между собой пептидной связью. Следовательно, первичная структура белка определяется тем, какие аминокислоты, сколько и в какой последовательности входят в состав полипептидной цепи. Пептидная связь образуется за счет взаимодействия a-карбоксильной группы одной аминокислоты и a-амино-группы другой аминокислоты. В структурных формулах пептидов связь между карбонильным углеродом и атомом азота изображается как одинарная, однако на самом деле эта связь носит характер частично двойной связи. Действительно, классическая двойная связь между атомами С и О обеспечивала бы свободное вращение между атомами С и N в пептидной связи (Рис. 2.2а). В случае другого крайнего варианта: наличии двойной связи между атомами С и N (Рис. 2.2б) вращение вокруг этой связи было бы невозможным, но при этом атомы О и N пептидной группы приобретали бы слишком высокие заряды (атом N – положительный, а атом О – отрицательный). Истинная электронная плотность между атомами С, О и N в пептидной группе имеет промежуточное значение. Величина свободной энергии в 88 кДж/моль является достаточным препятствием, затрудняющим вращение связи С—N, но сохраняющей планарную структуру пептидной связи. По этой причине свободное вращение вокруг связи С—N невозможно, и все четыре атома пептидной связи (Рис. 2.2в) лежат в одной плоскости. Вращение вокруг остальных связей полипептидного остова, наоборот, достаточно свободное. Такая полужесткость структуры имеет важное значение для формирования более высоких уровней структурной организации белковых молекул.
Рисунок 2.2 – Резонансная стабилизация пептидной связи придает ей характер частично двойной, чем объясняется заметная жесткость связи между атомами C и N.
Вторичная структура Этот уровень структурной организации описывает стерические взаимосвязи между расположенными близко друг к другу аминокислотами. Вторичная структура может быть регулярной (a-спираль, складчатый b-слой) или не обнаруживать признаков регулярности (неупорядоченная конформация). Тем не менее, во всех случаях в основе формирования вторичной структуры лежит образование многочисленных водородных связей между карбонильными кислородами одного остатка аминокислоты и водородом, принадлежащим атому азоту пептидного остова другой аминокислоты. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 355. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||