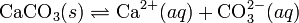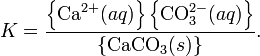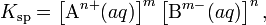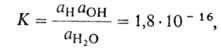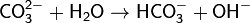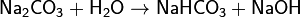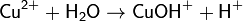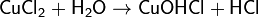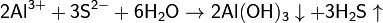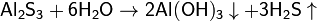Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Теория электролитической диссоциацииКислоты — это вещества, образующие в водном растворе ионы гидратированные катионы водорода Н+ (ионы гидроксония) и анионы кислотного остатка. Реакция нейтрализации (соль - NaCl):HCl + NaOH = NaCl + H2O Критерии протекания реакции. Сильные кислоты реагируют с сильными основаниями. Чем слабее кислота, тем более сильное основание нужно для реакции. Ионные уравнения При составлении ионных уравнении следует руководствоваться тем. что формулы веществ малодиссоцвшрующих. нерастворимых и газообразных записываются в молекулярном виде. единений, не содержащих гидроксогрупп.  7.7 Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
Константа этого равновесия рассчитывается по уравнению:
Константа равновесия такого процесса называется произведением растворимости.
Диссоциация воды - разложение воды на составляющие химические элементы.Диссоциация воды является эндотермической реакцией H2O ↔ H+ + OH- ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН), равен -lg aH, где aH-термодинамич. активность ионов Н+ в р-ре (в моль/л). Водородный показатель - количеств. характеристика кислотности водных р-ров. Вода диссоциирует на ионы Н + и ОН-. Константа равновесия этого процесса при 22 °С:
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном . Различают обратимый и необратимый гидролиз солей[1]:
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 344. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |