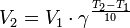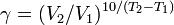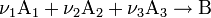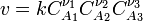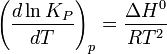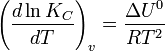Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Скорость химической реакции зависит отприроды реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ. v = kcA cB , где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций. Зависимость скорости реакции от температуры определяетсяправилом Вант-Гоффа:При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
выражает зависимость скорости хим. р-ции от концентраций компонентов реакц. смеси. Для простой (одностадийной) гомог. р-ции скорость v пропорциональна произведению концентраций реагирующих в-в и кинетическое уравнение записывается в виде:
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции от температуры Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: 
температурный коэффициент вычисляется по формуле: 6.3 Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1] Типы катализа положительный (скорость реакции растет) и отрицательный (скорость реакции падает-ингибиторы расходуется). Гомогенным(такаяже фаза H2О2 + I → H2О + IO) и гетерогенным(разные фазы окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты). ХИМИЧЕСКОЕ РАВНОВЕСИЕ
2NO2(г) « N2O4(г); CO(г) + H2O(пар) « CO2(г) + H2(г) КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
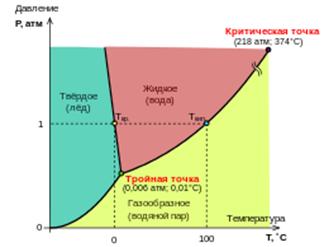
(a = n (A), b = n (B), p = n (P), q = n (Q)) при условии, что прямая (® ) и обратная ( ) реакции протекают в одну стадию. Зако́н де́йствующих масс скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. в виде кинетического уравнения вида: Принцип Ле Шателье — Брауна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. уравнением изобары Вант-Гоффа: в системах с газовой фазой — уравнением изохоры Вант-Гоффа 7.1 Фа́зовая диагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме
|
|||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 451. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
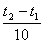 vt 2 = vt 1 γ ,
vt 2 = vt 1 γ ,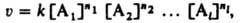
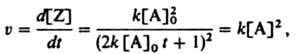
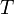 .
.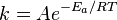 основная,
основная, 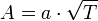 зависит от температуры
зависит от температуры