Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Закон Рауля для неэлектролитовПервое следствие из закона Рауля. Повышение температуры кипения ΔТкип пропорционально моляльности раствора Сm ΔТкип. = КэСm,где Кэ – эбуллиоскопическая постоянная растворителя; Сm – моляльная концентрация раствора; ΔТкип. = Ткип р-ра – Ткип.р-рителя.Повышение температуры кипения обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя. Второе следствие из закона Рауля. Температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя.Это обусловлено более низким давлением пара растворителя над раствором, чем над чистым растворителем. Понижение температуры замерзания (кристаллизации) Тзам пропорционально моляльности раствора ΔТзам = Кк Сm , где Кк – криоскопическая постоянная, зависящая от природы растворителя.
Понятие об осмосе.
– это диффузия растворителя через полупроницаемую мембрану, разделяющую два раствора различной концентрации, из менее концентрированного в более концентрированный.Второй закон гонит растворитель из области меньшей концентрации раствора в область большей концентрации. При этом в области большей концентрации возникает осмотическое давление p , равное, по уравнению Вант-Гоффа: p = CRT
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. 1) понижение давления насыщенного пара растворителя над раствором, 2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.  3) осмотическое давление. Зная температуры кипения и замерзания чистых растворителей и Dt можно рассчитать температуры кипения и замерзания растворов:
tкип.(р-ра) = tкип.(р-ля) + Dtкип. tзам.(р-ра) = tзам.(р-ля) – Dtзам.
Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
Осмотическое давление – сила, обуславливающая осмос. Оно равно внешнему давлению, при котором осмос видимо прекращается.
растворам электролитов, Это поправочный коэффициент, который учитывает увеличение числа частиц в растворе электролита из-за диссоциации на ионы.
Изотонический коэффициент безразмерный параметр, характеризующий поведение вещества в растворе.
Диссоциация процесс, заключающийся в распаде молекул на несколько более простых частиц — молекул, атомов, радикалов или ионов. Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать обратимым образом на маленькие объекты, В общей реакции
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных системах.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 497. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
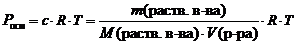 ,
,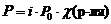
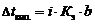
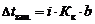
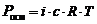
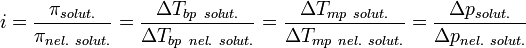 ,
,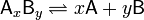 константа диссоциации определяется так:
константа диссоциации определяется так: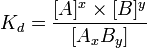
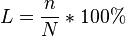
 — число недиссоциированных молекул.
— число недиссоциированных молекул.