
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Гибридизация атомных орбиталейпары внешних электронов центрального атома, располагаются в пространстве как можно дальше друг от друга.Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. В результате гибридизации появляются новые гибридные орбитали которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары оказались максимально удаленными друг от друга Метод валентных связей 1. Одинарная ковалентная химическая связь осуществляется двумя валентными электронами, по одному от каждого из взаимодействующих атомов. При этом у образующих валентную пару электронов спины должны быть противоположными. 2. Исходные атомные орбитали, сохраняют свой абрис и в составе молекулы. 3.Связь образуется за счет перекрытия орбиталей, приводящего к увеличению электронной плотности между ядрами взаимодействующих атомов в направлении, обеспечивающем максимальное перекрытие. 4.2Ионная связь прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. (MgS, K2CO3), основания(LiOH, Ca(OH)2), основные оксиды(BaO, Na2O)
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Водородные связи могут быть межмолекулярными или внутримолекулярными.вода как пример 4.4 металическая связь  Атомы, оставшиеся без внешних электронов, приобретают положительный заряд..Совокупность обобществлённых валентных электронов заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью 4.5 Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. . Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей Энтальпия — это термодинамическое свойство вещества, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Энтропия — это сокращение доступной энергии вещества в результате передачи энергии. Вну́тренняя эне́ргия тела (E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы.
Свободная энергия Гиббса— это величина, показывающая изменение энергии в ходе химической реакции 0 Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, свободной энергией Гиббса Свобо́дная эне́ргия Гельмго́льца — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 332. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
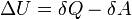
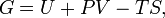
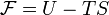 , где
, где 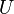 — внутренняя энергия,
— внутренняя энергия, 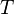 — абсолютная температура,
— абсолютная температура, 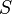 — энтропия.
— энтропия.