Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Орбитальное квантовое число (l)Стр 1 из 9Следующая ⇒ Газовые законы 1) при постоянной тем(t) изменение V газа обратно пропорц. изменению давления (закон Бойля - Мариотта); 2) при постоян давлении измен V газа прямо пропорц измеан бсолютной температуры (закон Шарля - Гей-Люссака); 3) при постоянных t и давлении изменение объема прямо пропорц изменению количества вещества (закон Авогадро). Эти закон в уравнения сост идеального газа PV = nRT Если два газа смешать при постоянных t и давлении, то V смеси будет =сумме объемов газов,; при постоянномV давление смеси газов, хим не взаимодействующих друг с другом, =сумме парциальных давлений газов, сост смесь (закон парциальных давлений, установленный Дальтоном). Парциальное давление - это давление компонента идеальной газовой смеси, которое он оказывал бы, если бы один занимал объем всей смеси. Мольная доля одного из компонентов газовой смеси - это та часть всех молекул газа, которую составляют молекулы данного компонента. Для любого газа в смеси Молн доля=числ молей газа/общ.число молей газ=парц.давлен.газа/суммарн.давлен Важнейшие классы неорганических соединений. Оксид - это вещ из 2 элем, в состав которых входит кислород.Бывают основные и кислотные. Кислотные макс ст окис. серы +4, +6. Кисллт оксиды из неметаллов. осно.оксиды металлами.( вступают в реакции нейтрализации с образованием соли и воды). кислоты, и основания отдают свой ион в химических реакциях При реакции кислоты и основания образуются соли. кислота – это вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. Свойства кислот способны заменять в своих молекулах атомы водорода на атомы металлов. Взаимодействие кислот с основаниями. И обр соли. И воды.  Соли - это вещ в которых атомы метал связаны с кисл остатком. Исключение (NH4)2SO4 – сульфат аммония .Все соли разделяются на средние(Na2SO4) , кислые(Н) и основные. (ОН) 1.6 Способы выражения концентрации растворов Массовая доля растворённого вещества w(B)= m(B) / m Молярная концентрация C(B) = n(B) / V = m(B) / (M(B) · V) Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. 1 грамму водорода или 8 граммам кислорода. Мольная доля растворенного вещества ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) ; ks = mв-ва / mр-ля . ; s = (mв-ва / mр-ля) ∙ 100.
Модель атома Резерфорда Рассеяние отдельных α-частиц на большие углы объяснил тем, что полож заряд в атоме не распределен равномерно в шаре. для объяснения нужно принять радиус атомного ядра равным примерно 10-15м. атом устроен подобно планетарной системе. электроны в атоме обращаются вокруг атомного ядра. Радиус круговой орбиты самого далекого от ядра электрона и есть радиус атома. планетарной моделью. болш часть пространства в атоме между атомным ядром и обращ вокруг него электронами пуста, быстро заряженные частицы могут свободно проникать через слои вещества, содержащие несколько тысяч слоев атомов.При столкновениях с отдельными электронами быстрые заряженные частицы испытывают рассеяние на большие углы, так как масса электрона мала. Однако в тех редких случаях, когда быстрая заряженная частица пролетает на очень близком расстоянии от одного из атомных ядер, под действием силы электрического поля атомного ядра может произойти рассеяние заряженной частицы на любой угол до 180°. Квантовые постулаты Бора 1. Электрон в атоме можеь находиться только в определенных устойчивых состояниях, называемых стационарными, каждому из которых соответствует определенная энергия En. В этих состояниях атом не излучает электромагнитных волн(meυr = nħ (n = 1,2,3,…), где n – главн квант чис, me – м покоя элек, υ –элект, r –орбит, ħ – постоян Планка. 2. При переходе атома из одного стационар сост в др испускается или поглощается квант энергии ΔE = hν. Излучение фотона происходит при переходе атома из состс боль энерг в сост с мен энер-й. При обратном переходе поглощкванта энер: hν = En - Em..3все стацион состя, явл стац условно. Бескондолго каждый атом может наход лишь в стац состс миним запасом энергии. Это сост атома называется основным. Все ост стац сост -возбужденными. У-ие дебройля Для частиц движущихся со
2.3у-ие Шредингера Ура-ие, опис изменение в простр и во времени чист сост, задаваемого волновой функц, в гамильтоновых квантовых сист. урав движения квантовой частицы. равн для частиц без спина, движущихся со скоростями много меньшими скорости света. Зависимое от времени уравнение (общий случай) уравнение Шрёдингера 2.3орбиталь Атомная орбиталь – пространство вокруг ядра, в котором наиболее вероятнонахождение электрона. Электроны, движущиеся в орбиталях, образуют электронные слои, или энергетические уровни.Главное квантовое число(n) — целое число, обозначающее номер энерг уровня. Характ энергию элек-в, занимающих данный энергет уровс. При увелич главкванто числа возрастают радиус орбиты и энергия элек-а. Главное квантовое число равно номеру периода элемента.N = 2n2, где n – главное квантовое число;N – максимальное количество электронов.Орбитальное квантовое число (l) Орбит квант число описыв форму орбитали, и форму электр облака. 1 — s 2 — p 3— d 4— f — g 6 — h.для электрона первого энергетического уровня (n = 1) возможна только одна форма орбитали, для второго энергетического уровня (n = 2) |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 370. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
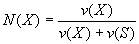
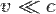 , импульс равен и
, импульс равен и 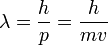 . Следовательно, L волны тем меньше, чем больше m частицы и её скорост . Для электронов с энерг от 1 эВ до 10 000 эВ длина волны от ~ 1 нм до 10−2 нм, то есть в интервале длин волн ренген излуч. волновые св электронов проявлятся.
. Следовательно, L волны тем меньше, чем больше m частицы и её скорост . Для электронов с энерг от 1 эВ до 10 000 эВ длина волны от ~ 1 нм до 10−2 нм, то есть в интервале длин волн ренген излуч. волновые св электронов проявлятся.