
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Типы гибридизации комплексных соединений. Внешнеорбитальные и внутриорбитальные комплексные соединения.Для катионов d- элементов характерны октаэдрические комплексы. При их образовании возможны два типа гибридизации: d2sр3 и sр3d2, в зависимости от того, какие d-орбитали комплексообразователя доступны для лиганд.
При внутренней гибридизации лиганды прочно связаны с комплексообразователем, поэтому внутриорбитальные комплексы отличаются высокой устойчивостью.
Лиганды, обладающие достаточной электронодонорной способностью, могут «вытеснить» электроны с двух орбиталей d подуровня и заставить их спариться на остальных двух орбиталях. При этом нарушается правило Гунда. Такой способностью обладают, например: цианид-ионы, поэтому они образуют внутриорбитальные комплексы Если же лиганд не обладает достаточной электронодонорной способностью, то образуется внешнеорбитальный комплекс, например: [Fe(Н2О)6]2+(Число неспаренных электронов в процессе комплексообразования в этом случае не меняется)  5. Устойчивость комплексных соединений в растворе. Константа нестойкости комплексных соединений, еѐ связь с константой устойчивости. Ионы внешней сферы соединены с комплексом ионной связью, поэтому в водных растворах они легко отщепляются: [Fe(Н2О)6]SO4 ↔ SO42- + [Fe(Н2О)6]2+. Этот процесс называется первичной диссоциацией. Внутренняя сфера в зависимости от прочности также способна диссоциировать на комплексообразователь и лиганды: [Fe(Н2О)6]2+ ↔ Fe2+ + 6 Н2О – это вторичная диссоциация. Она аналогична диссоциации слабых электролитов и характеризуется константой равновесия: Крав. = константа равновесия может служить мерой прочности комплекса: чем менее стоек комплекс, тем больше концентрация простых ионов или молекул Fe2+ и Н2О, тем больше численное значение константы. Поэтому константу равновесия, называют константой нестойкостикомплекса. Величина, обратная константе нестойкости, называется константой устойчивости: Куст.= |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 650. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
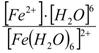
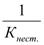 =
= 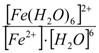 .
.