
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Понятие экзергонических и эндергонических процессов.Экзергонические процессы – химические реакции, в результате которых уменьшается энергия Гиббса и система совершает работу. Эндергонические процессы – химические реакции, в результате которых возрастает энергия Гиббса и над системой совершается работа. ПРЕДМЕТ И ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Предмет химической кинетики. Скорость реакции, средняя скорость реакции в интервале, истинная скорость. Химическая кинетика изучаетзакономерности протекания химических процессов во времени. Для начала реакции необходимо ослабить и разорвать связи в молекулах исходных веществ. Затем частицы начинают двигаться и во время движения испытывают столкновения, но не все столкновения приводят к началу реакции, а только те, которые обладают избыточной энергией. Эта энергия называется энергией активации. Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени: dc V=± dt Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при dt→0 Скорость химической реакции зависит от: природы реагирующих вещ-в, концентрации, температуры, присутствия катализаторов и т.д. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные).  В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах. Микрогетерогенныереакции – это реакции происходящие в коллоидных системах. Простыми называют реакции, протекающие в одну стадию. Сложными называют реакции, протекающие в несколько стадий. Выделяют следующие виды сложных реакций: 1) параллельные: протекание нескольких процессов с участием одних и тех же веществ; 2) последовательные: конечные продукты образуются через ряд промежуточных продуктов, 3) сопряженные: протекание одной реакции инициирует осуществление второй; 4) цепные: протекающие через ряд регулярно повторяющихся элементарных стадий Молекулярность элементарного акта реакции. Порядок реакции. Молекулярность реакции - число молекул, реагирующих в одном элементарном акте реакции. По молекулярности различают мономолекулярные, бимолекулярные, тримолекулярные реакции Порядокреакции — это число, равное сумме показателей степени концентраций реагирующих веществ в уравнении скорости. 1) Реакции нулевого порядка (n=0). 2) Реакции первого порядка ( n=1). 3) Реакции второго порядка ( n=2). Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции. Зависимость скорости реакции от концентрации. Закон действующих масс. Константа скорости химической реакции. Основной постулат химической кинетики – закон действующих масс аА + вВ = АВ W = k [A]а∙[B]b Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в степени равной их молярным коэффициентам. Эти степени называются частными порядками реакции: а - частный порядок реакции по веществу А, b - частный порядок реакции по веществу В. Сумма частных порядков дает полный порядок реакции n: n=a+b. k - константа скорости реакции.( не зависит от значения концентраций реагентов) |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 524. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
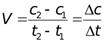 СКОРОСТЬ ВСЕГДА ПОЛОЖИТЕЛЬНА
СКОРОСТЬ ВСЕГДА ПОЛОЖИТЕЛЬНА