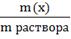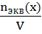Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Понятие о химическом эквиваленте, закон эквивалентов и его следствие.Стр 1 из 26Следующая ⇒ Раствор как гомогенная система. Растворитель, растворенное вещество. Классификация растворов по степени дисперсности, по растворимости в воде, по способности к диссоциации. Растворы- гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции. Растворитель - тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. В лабораторной практике различают концентрированные растворы(содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя). Иногда растворы определяют как дисперсные системы. При этом растворитель, в котором распределено вещество, называется дисперсной средой, а частицы растворенного вещества - дисперсной фазой. По степени дисперсности различают 1) Взвеси- это дисперсные системы, в которых размеры распределенных частиц сравнительно велики (10^-7-10^-5м ). Делятся на : суспензии (распределенное вещ-во твердое) и эмульсии (распределенное вещество жидкое). Взвеси неустойчивы, частицы диспергированного вещ-ва выпадают в осадок либо всплывают. Процесс разделения взвесей для суспензий-седиментация, для эмульсий-расслоение. 2) Коллоидные системы-частицы распределенного вещества имеют размеры порядка 10^-9-10^-7 м. Каждая частица может содержать большое число атомов или молекул. Видны в ультрамикроскоп, где свет падает сзади либо сбоку. 3) Истинные растворы-диспергированное вещ-во распределено в среде в виде молекул или ионов, частицы имеют размеры порядка 10^-10-10^-7м. Растворы однородные, устойчивые.  Классификация по растворимости в воде:
Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр). 1. Массовая доля (ω)- отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах. ω (х)= Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора. 2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора. См= Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М. 1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества); 0,1М – децимолярный раствор; 0,01М – сантимолярный раствор; 0,001М – милимолярный раствор. 3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество моль- эквивалентов вещества, содержащегося в 1 л раствора. СN= Единица измерения моль-экв/л, Сокращенно обозначается буквой N. 4.Титр- титрованная концентрация (Т). Показывает сколько грамм растворенного вещества содержится в 1 мл раствора (выражается в г\мл) m(вещ-ва) V-объем в мл T=_________ V n экв N Mэкв(х) N-нормальная концентрация ____ ; Mэкв(х)- моль-экв масса вещ-ва Т=____________ V 1000 Понятие о химическом эквиваленте, закон эквивалентов и его следствие. Эквивалент вещества - такое количество его, которое взаимодействует с одним моль атомов водорода или вообще с одним эквивалентом любого другого вещества. Обозначается эквивалент Э (Х), выражается в молях. Закон эквивалентов: Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам.
m1, m2- массы веществ, Э1, Э2- эквиваленты веществ.
4. Эквивалентная масса вещества, еѐ связь с молярной массой для различных классов неорганических соединений. Масса одного эквивалента вещества называется эквивалентной массой, обозначается Мэкв, выражается в г/моль-экв. Эквивалент зависит от типа реакции. Способы расчета Мэкв. • • • |
|||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 522. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |