
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
По стандартным энтальпиям (теплотам) образования веществСтандартная теплота образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=298 К, Р=1 атм=101325 Па Теплоты образования простых веществ равны нулю. Единицы измерения
νi , νj – стехиометрические коэффициенты перед соответствующими веществами в уравнении реакции. Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях. Единицы измерения Теплоты сгорания высших оксидов (в том числе СО2 и Н2О) приняты равными нулю.
Закон Гесса и его следствия (формулировка и математическое выражение). Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объёме, не зависит от пути процесса, а только от начального и конечного состояний системы. Если из одних веществ можно получить другие разными путями, то суммарный тепловой эффект по первому пути равен суммарному тепловому эффекту по второму пути. Закон Гесса позволяет на практике рассчитывать тепловые эффекты реакций, которые сложно отслеживать или на это требуется длительное время. ∆H₁=∆H₂+∆H₃=∆H₄+∆H₅+∆H... Энтропия. Второй закон термодинамики (формулировка и математическое выражение). Обратимые и необратимые в термодинамическом смысле процессы. Второй закон термодинамики (второе начало термодинамики): Самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды ΔSсист + ΔSсреды ≥ 0 или ΔS ≥ 0 Для химической реакции изменение энтропии  Энтропия (S) -мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу. Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру. Энтропия – экстенсивная функция. Энтропия системы равна сумме энтропий составных частей. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода. Энтропию относят к 1 молю вещества в стандартных условиях S°298 ; измеряют ее в энтропийных единицах (э.е.): 1 Дж/мoль*К = 1 э.е. Больцман постулировал, что энтропия связана с термодинамической вероятностью логарифмической зависимостью
S = k ln Wуравнение Больцмана k – константа Больцмана: k = 1,38∙10-23 Дж/градус; W – число микросостояний, с помощью которых можно реализовать данное макросостояние: Р – вероятность того, что система находится именно в этом микросостоянии. Термодинамически обратимый процесс– процесс, протекающий в прямом и в обратном направлении без изменений в системе и в окружающей среде, т.е. при переходе из начального состояния в конечное все промежуточные состояния являются равновесными. При наличии неравновесных промежуточных состояний процесс считают термодинамически необратимым. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов. Термодинамические условия равновесия. Энергия Гиббса– функция состояния, являющаяся критерием самопроизвольности процессов в открытых и закрытых системах. G=H–TS H- энтальпия, Т- температура, S- энтропия. Используя энергию Гиббса, второй закон термодинамики можно выразить так: При постоянстве температуры и давления в системе самопроизвольно протекают только процессы, ведущие к уменьшению энергии Гиббса. В состоянии равновесия энергия Гиббса равна нулю ∆G ≤0 (р, Т=const) При ∆G<0 реакция самопроизвольно протекает в прямом направлении; ∆G>0 в обратном направлении ∆G=0 реакция находится в состоянии равновесия. Изменение ЭГ определяется формулой: ΔG=ΔH–TΔSСтандартная ЭГ определяется формулой:
где
Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG< 0 (для закрытых систем),ΔS> 0 (для изолированных систем). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (ΔrS) фактором. Для реакций, у которых ΔrH< 0 и ΔrS> 0, энергия Гиббса всегда будет убывать, т.е. ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах В изолированных системах энтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS= 0. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 507. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |


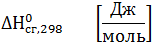

 прод -
прод - 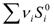 исх
исх
