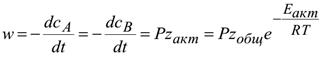Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Зависимость скорости реакции от температуры. Правило Вант-Гоффа.Скорость химической реакции увеличивается с повышением температуры. Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов, скорость реакции увеличивается в 2-4 раза
где V2 – скорость протекания реакции при температуре t2, а V1 – скорость протекания реакции при температуре t1; ɣ - температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей при температуре t+10 и t. Энергия активации. Уравнение Аррениуса. Энергетический профиль реакции. Энергия активации- это та избыточная энергия, которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции. (Активация вызывается повышением температуры, действием квантов света и т. д.) Энергия активации постоянна в данном температурном интервале и определяется механизмом реакции. Ее можно определить графически по уравнению Аррениуса:
Зная энергию активации и константу скорости при одной температуре, можно определить константу скорости при другой темепратуре или Зная величины констант скоростей при двух температурах, можно расчитать значение энергии активации.
Или R- T- температура в Кельвинах Понятие о теории активных соударений, образование активированного комплекса. Теория активных соударений. Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема w=qzобщ, где q – коэффициент пропорциональности; zобщ– общее число столкновений.  В теории соударений используются следующие допущения: 1. Частицы бесструктурны – это шары с радиусом r; 2. В момент соударения молекулы ведут себя как упругие шары. Т.е. суммарная энергия молекул до и после соударения остается постоянной, но может перераспределяться между молекулами. 3. Реагируют только молекулы, которые обладают энергией активации. 4. Число двойных активных столкновений определяется соотношением:
где zобщ– общее число столкновений, zакт– число активных столкновений,
5. Процесс превращения исходных веществ в продукты происходит мгновенно в момент соударения активных молекул. 6. Скорость реакции А+В=С определяется выражением
где Р – стерический фактор. Он определяется опытным путем из соотношения опытной и теоретической скорости. Р<1. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 564. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
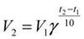
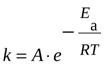 где А-предэкспоненциальный множитель
где А-предэкспоненциальный множитель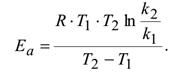
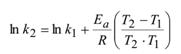
 газовая постоянная,
газовая постоянная,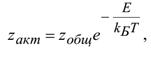
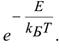
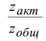 -доля активных столкновений, равная множителю Больцмана
-доля активных столкновений, равная множителю Больцмана