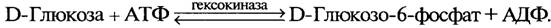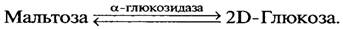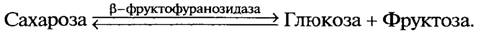Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
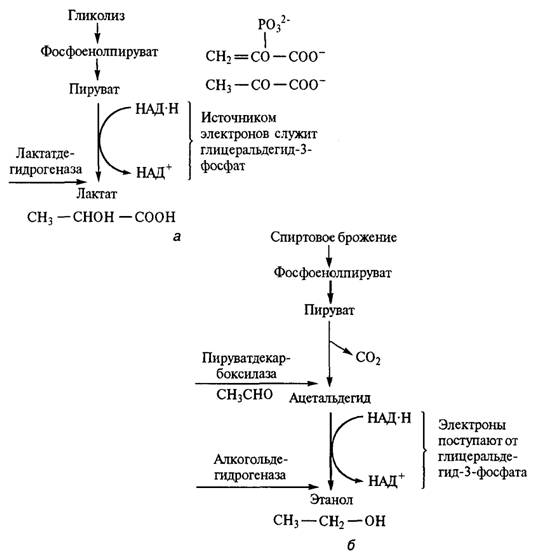
СПИРТОВОЕ БРОЖЕНИЕ И ГЛИКОЛИЗПроцесс спиртового брожения сопровождается образованием АТФ, аденозиндифосфата (АДФ) и фосфата, при этом из одной молекулы D-глюкозы образуется две молекулы АТФ. Кроме того, от глицеральдегид-3-фосфата к пировиноградной кислоте переносятся 4 электрона в форме 2НАД • Н+ + 2Н+. Спиртовое (анаэробное) брожение вызывают дрожжи — микроорганизмы из класса сумчатых грибов. Для дрожжей (хлебопекарных, спиртовых, пивных, винных), сбраживающих глюкозу до спирта и диоксида углерода, а не до молочной кислоты, характерен процесс брожения, совпадающий с гликолизом во всем, кроме концевого этапа, катализируемого лактатдегидрогеназой. При спиртовом брожении этот этап заменяется двумя другими ферментативными реакциями (рис. 2.7), катализируемыми соответственно пируватдекарбоксилазой и ал-когольдегидрогеназой, при этом процессы гликолиза и спиртового брожения тесно связаны между собой. Начальные этапы спиртового и других видов брожения, вплоть до образования пировиноградной кислоты (пирувата), полностью идентичны гликолизу. Более того, сравнительное изучение процессов анаэробного расщепления углеводов различными микроорганизмами показало, что ферменты и катализируемые ими реакции, протекающие с участием фосфорной кислоты, во всех случаях общие и эта общность сохраняется до образования из субстрата пировиноградной кислоты. Ферменты, катализирующие эти превращения, найдены в дрожжах, бактериях, тканях животных, семенах, листьях и клубнях. Все эти биохимические превращения происходят без участия кислорода воздуха, т. е. в анаэробных условиях. Уникальным свойством дрожжевой клетки является непрерывное получение энергии — химической, электрической и т. д., необходимой для ее метаболизма и физиологических функций. Энергия в клетке накапливается в результате окислительно-восстановительных реакций.  Брожение определяют как глубокий распад сахара и других углеродсодержащих соединений, происходящий под действием живых клеток или выделенных из них ферментов.
Рис. 2.7. Сбраживание глюкозы при гликолизе (а) и спиртовом брожении(б) В процессе спиртового брожения в качестве основных продуктов образуются этанол и диоксид углерода (рис. 2.8), побочных — янтарная кислота, ацетальдегид, глицерин и др. Спиртовое брожение включает промежуточные окислительно-восстановительные реакции, но никогда не приводит к полному окислению органических веществ. Одновременно осуществляются и биосинтетические реакции. Основная цель брожения — перестройка структуры молекул гексозы или другого улеродсодержащего соединения. Эти перестройки обусловливают биохимические превращения исходного субстрата, протекание окислительно-восстановительного процесса и образование высокоактивного и лабильного в химическом отношении метаболита — пировиноградной кислоты, при этом спирт (С2Н5ОН) можно рассматривать как восстановительное соединение, а диоксид углерода (СО2) — как окислительное, поскольку в его молекулах водород отсутствует.
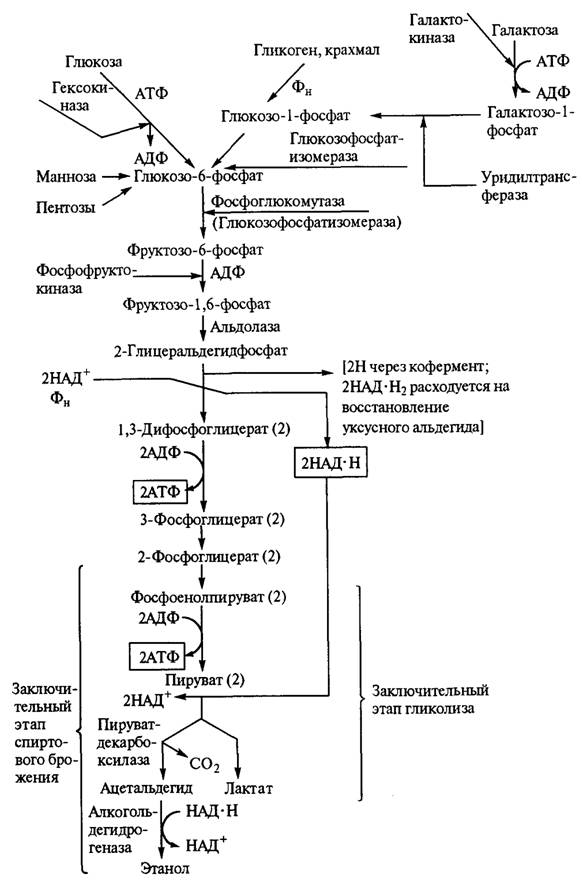
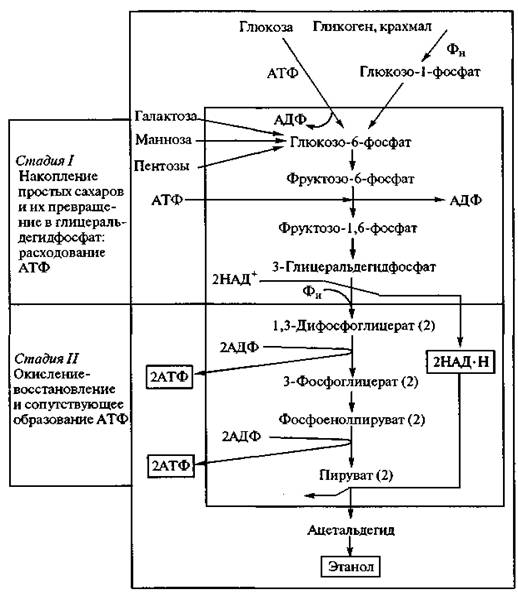
Рис. 2.8. Схема анаэробного расщепления углеводов, включающая заключительные этапы спиртового брожения и гликолиза Различают две стадии спиртового брожения. На первой стадии различные гексозы вовлекаются в процесс диссимиляции, фосфорилируясь за счет АТФ и образуя глицеральдегид-3-фосфат, на второй — происходят окислительно-восстановительные реакции и накопление энергии, т. е. этапы, в ходе которых АДФ фосфорилируется до АТФ (рис. 2.9). Выделяющийся диоксид углерода разрыхляет тесто, обеспечивая пористость в готовом хлебе. Спирт и другие продукты брожения участвуют в образовании его аромата. Разные сахара сбраживаются с разной скоростью. Наиболее легко сбраживаются глюкоза и фруктоза, медленнее — манноза и галактоза; пентозы дрожжами не сбраживаются, а утилизируются некоторыми микромицетами из рода Fusarium. Из дисахаридов хорошим субстратом для спиртового брожения являются сахароза и мальтоза, но после предварительного гидролиза их на моносахара соответственно ферментами β-фруктофуранозидазой и a-глюкозидазой. Клетки дрожжей и других микроорганизмов в аэробных условиях наибольшую часть энергии получают в результате дыхания, при котором электроны переносятся от органических молекул на молекулярный кислород. Дыхание — значительно более сложный процесс, чем спиртовое брожение (гликолиз), протекающий на стадии размножения микроорганизмов при их производстве (рис. 2.10). Процесс дыхания можно представить суммарным уравнением С6Н12О6 + 6О2 → 6СО2 + 6Н2О+ 2800 кДж. Первые этапы этого пути, основанного на образовании энергии, совпадают с анаэробным окислением глюкозы. Расхождение начинается на стадии образования пировиноградной кислоты. Первоначально считали, что пировиноградная кислота подвергается окислительному декарбоксилированию с образованием уксусной кислоты: СН3–СО–СООН + 1/2 О2 -> СН3СООН + СО2. Потом было установлено, что уксусная кислота не является промежуточным продуктом при декарбоксилировании пировиноградной кислоты, и возникло предположение, что уксусная кислота существует в «активной» форме. Установлено, что для утилизации пирувата необходим коэнзим А (КоА) — нуклеотид, в состав которого входят аденозин-3',5-дифосфат, пантотеновая кислота и тиоэтиламин. Коэнзим А участвует в переносе остатка уксусной кислоты — ацетильного радикала (СН3СО—), а также других кислотных (ацетильных) радикалов.
Рис. 2.9. Две стадии спиртового брожения
Окислительное декарбоксилирование пирувата — процесс многоступенчатый, осуществляется сложной ферментативной системой, в состав которой кроме пируватдекарбоксилазы, тиа-миндифосфата и коэнзима А входят дегидрогеназы с коферментом НАД+ и ФАД, липоевая кислота и ионы магния. В результате окисления пировиноградной кислоты образуются молекула аце-тил-КоА («активной» формы уксусной кислоты), молекула диоксида углерода и два атома водорода (в виде НАДН + Н+): СН3–СО–СООН +HS - КоА + НАД+ → CH3–CO–S–KoA + СО2 + + НАДН + Н+.
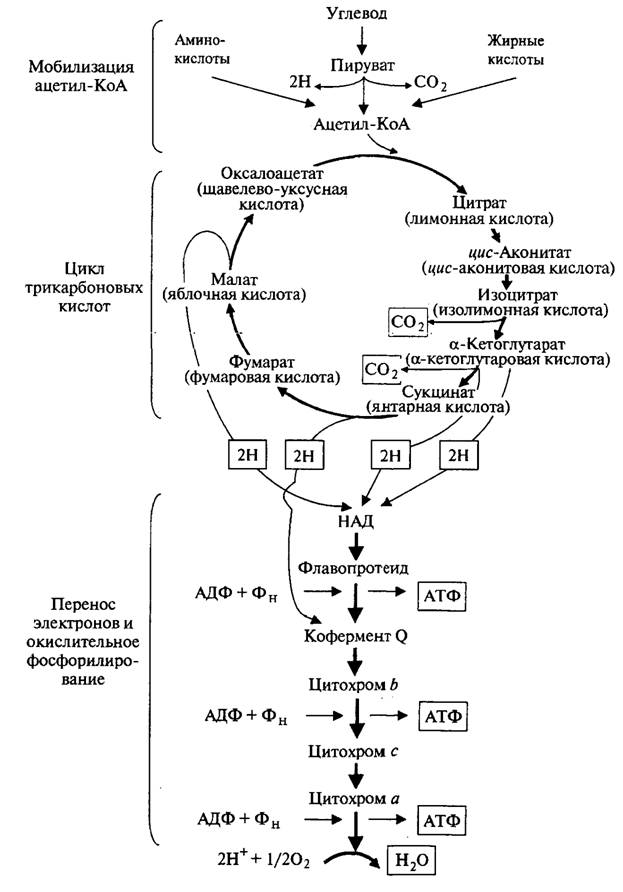
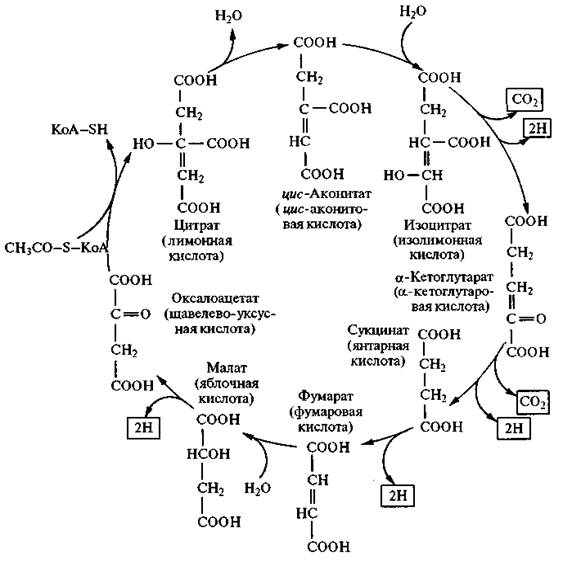
Рис. 2.10. Схема распада углеводов в аэробных условиях (в рамках приведены конечные продукты каждой стадии) Далее при непрямом аэробном окислении глюкозы происходит полное окисление ацетил-КоА в цикле Кребса до диоксида углерода и воды (рис. 2.11).
Рис. 2.11. Цикл трикарбоновых кислот: в рамках приведены конечные продукты (2СО2 и четыре пары атомов Н)
Исследования показали, что окисление ацетил-КоА возможно лишь в присутствии небольшого количества какой-либо дикар-боновой кислоты. Вначале ацетил-КоА конденсируется с оксало-ацетатом (СООН—СН2—CO—COOH) с образованием цитрата (трикарбоновой кислоты). Цитрат является первым продуктом цикла Кребса, поэтому иногда его называют лимоннокислым. Образовавшийся цитрат подвергается далее ряду сложных превращений, прежде всего дегидратированию с образованием цисаконитата (цис-аконитовой кислоты). Последний присоединяет молекулу воды и переходит в изоцитрат (изолимонную кислоту). Изоцитрат подвергается дегидрированию и превращается в щавелево-янтарную кислоту, которая декарбоксилируется с образованием a-кетоглутарата. Последний подвергается окислительному декарбоксилированию и одновременно дегидрируется, переходя в сукцинил-КоА, который превращается в сукцинат (янтарную кислоту). Сукцинат дегидрируется, превращаясь в фумарат (фумаровую кислоту), затем в малат (яблочную кислоту). При дегидрировании из малата образуется оксалоацетат (щавелево-уксусная кислота). На этом цикл Кребса замыкается. Многие реакции цикла легкообратимы. Ферменты, катализирующие реакции цикла Кребса, сосредоточены в митохондриях. Из приведенной схемы цикла Кребса видно, что в результате реакций дегидрирования образуются четыре пары водородных атомов и две молекулы СО2. Освободившийся в процессе окисления водород поступает в цепь биологического окисления и в итоге окисляется молекулярным кислородом с образованием воды и выделением энергии. При окислении в цикле ди- и трикарбоновых кислот из одной молекулы ацетил-КоА образуются двенадцать молекул АТФ, из которых одиннадцать возникают путем окислительного фосфорилирования, а одна — субстратного (при превращении сукцинил-КоА в янтарную кислоту). При окислении большинства субстратов в цепи биологического окисления происходит образование трех молекул АТФ, тогда как окисление некоторых из них (например, янтарной кислоты) дает две молекулы АТФ. Энергетический баланс анаэробного и аэробного окисления глюкозы выглядит следующим образом: 1. Две молекулы АТФ — это чистый прирост АТФ при превращениях глюкозы до пирувата в анаэробной фазе. Глюкоза + 2 НАД+ + 2АДФ + 2ФН → Пируват + 2НАДН + 2АТФ. 2. Четыре молекулы АТФ образуются в результате окисления двух молекул НАДН, образовавшихся при дегидрировании двух молекул 3-фосфоглицеринового альдегида. В связи с тем что эти две молекулы НАДН являются цитоплазматическими, отдаваемые ими электроны могут включиться в митохондриальную цепь биологического окисления не прямым путем, а с помощью так называемого челночного механизма. Сначала цитоплазматический НАДН реагирует с фосфодиоксиацетоном и образует глице-рол-3-фосфат. Фосфодиоксиацетон + НАДН ↔ Глицерол-3-фосфат + НАД+. Глицерол-3-фосфат легко проникает через митохондриальную мембрану и окисляется с участием флавинзависимой дегидрогеназы в фосфодиоксиацетон, причем простетическая флавиновая группа восстанавливается. Глицерол-3-фосфат + Флавопротеид → → Фосфодиоксиацетон + Флавопротеид Н2. Фосфодиоксиацетон выходит из митохондрий, а восстановленный флавопротеид передает приобретенные электроны в цепь биологического окисления, обеспечивая окислительное фосфорилирование только двух молекул АДФ. 3. Шесть молекул АТФ возникают в процессе окислительного декарбоксилирования двух молекул пирувата, образовавшихся в анаэробной фазе из одной молекулы глюкозы. 4. При полном окислении двух молекул ацетил-КоА в цикле Кребса возникает 24 молекулы АТФ. В итоге полного аэробного окисления одной молекулы глюкозы синтезируются 36 молекул АТФ. При анаэробном гликолизе (брожении) на одну молекулу глюкозы образуются всего две молекулы АТФ. Таким образом, выход энергии, запасаемой в виде АТФ при кислородном распаде глюкозы, в 18 раз больше, чем при анаэробном. Биотехнологическая ценность хлебопекарных дрожжей в хлебопекарном производстве определяется наличием в них двенадцати ферментов, катализирующих процесс спиртового брожения. Кроме них три фермента: a-глюкозидаза, β-фруктофуранозидаза и мальтотриаза — участвуют в подготовительной стадии брожения, а именно в образовании моносахаридов из дисахаридов (сахарозы, мальтозы) и мальтотриозы, не сбраживаемых непосредственно дрожжами. Наиболее важные ферментные системы брожения сконцентрированы в растворимой фракции цитоплазмы дрожжей. К ним относятся гексокиназа, глюкокиназа, проте-инкиназа,a-глюкозидаза, β-фруктофуранозидаза, пируватдекарбоксилаза и алкогольдегидрогеназа. Гексокиназа и глюкокиназа, относящиеся к классу трансфераз, переносят группы, содержащие фосфор, и являются фосфотрансферазами. Роль акцептора выполняет спиртовая группа. Гексокиназа — наиболее важный фермент, катализирующий фосфорилирование не только D-глюкозы, как глюкокиназа, но и фруктозы, маннозы, глюкозоамина. С помощью гексокиназы осуществляется первая внутриклеточная реакция. Реакция начинается с фосфорилирования углевода D-глюкозы АТФ, после чего глюкоза превращается в отрицательно заряженную частицу. Этот процесс катализируется гексокиназой и глюкокиназой, различающимися между собой по специфичности действия на сахара. Глюкокиназа характеризуется более низким сродством к a-D-глюкозе (Кт = 2 ∙ 10–2 М), чем гексокиназа (Кт = 1 ∙ 10–5 М), и вступает в действие, когда концентрация глюкозы достигает высокого уровня. Оба фермента нуждаются в присутствии двухвалентных катионов магния или марганца, которые связываются с АТФ, образуя истинные субстраты — MgATO2– или МnАТФ2–. Некоторые сульфгидрильные соединения действуют как ингибиторы гексокиназ.
Протеинкиназа участвует в образовании АДФ, АТФ и протеина. a-Глюкозидаза — представитель класса гидролаз, действуя на гликозиды, также участвует в подготовительной стадии брожения, а именно в образовании моносахаридов из дисахаридов — сахарозы и мальтозы. Скорость гидролиза этих сахаров a-глюкозидазой при рН 7,0 одинакова.
β-Фруктофуранозидаза катализирует гидролиз сахарозы на глюкозу и фруктозу. Этот фермент всегда присутствует в дрожжевой клетке независимо от того, есть сахароза в питательной смеси или нет. Он сосредоточен главным образом с внешней стороны мембраны клетки. Благодаря этому гидролиз сахарозы происходит прежде, чем она проникнет в клетку.
В то время как a-глюкозидаза гидролизует сахарозу у a-глюкозидного углеродного атома остатка глюкозы, β-фруктофуранозидаза разрывает связь, находящуюся у β-глюкозидного углеродного атома фруктозы. Так как в трисахариде раффинозе имеется связь между остатками глюкозы и фруктозы, как и в сахарозе, то β-фруктофуранозидаза гидролизует ее на фруктозу и дисахарид мелибиозу. Таким образом, в хлебопекарных полуфабрикатах β-фруктофуранозидаза дрожжей в период метаболизма обеспечивает полуфабрикаты моносахаридами за счет гидролиза сахарозы и раффинозы муки. В противоположность β-фруктофуранозидазе a-глюкозидаза локализуется в цитоплазме. Чтобы дрожжевая клетка могла использовать мальтозу, этот углевод должен проникнуть внутрь клетки и там гидролизоваться до глюкозы. Проникновение мальтозы через клеточную мембрану происходит под действием фермента мальтозопермеазы. Внутри клеток мальтоза гидролизуется с помощью a-глюкозидазы до двух молекул глюкозы, которая и подвергается сбраживанию. Другие указанные ферменты катализируют следующие реакции:
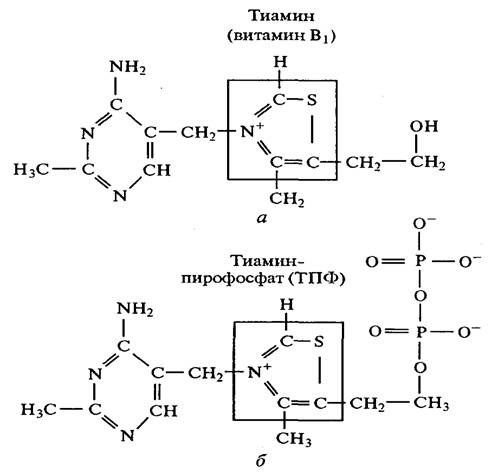
Как видно из сказанного, пируватдекарбоксилаза при спиртовом брожении декарбоксилирует пируват (пировиноградную кислоту) до ацетальдегида и СО2. Характерной особенностью этой реакции является ее необратимость. Этот фермент требует наличия ионов Mg2+ и кофермента тиаминпирофосфата (ТПФ), представляющего собой эфир пирофосфорной кислоты и тиамина. Этот комплекс необходим микроорганизмам в качестве фактора роста и источника витамина В1 (тиамин). Активной группой ТПФявляется тиазольное кольцо (рис. 2.12).
Рис. 2.12. Структура тиамина (в) и тиаминпирофосфата(б)
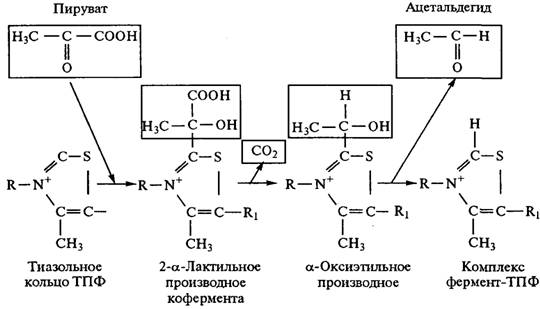
ТПФвыполняет функцию кофермента для целого ряда ферментов, катализирующих реакции как неокислительного, так и окислительного декарбоксилирования a-кетокислот, например пирувата (пировиноградной кислоты). Декарбоксилирование пирувата осуществляется через ряд промежуточных стадий, протекающих на поверхности фермента (рис. 2.13). Сначала a-углеродный атом пирувата атакуется сильно нукле-офильным 2-углеродным атомом тиазольного кольца ТПФ,связанного с ферментом, в результате чего образуется 2-a-лактильное производное кофермента. Этот промежуточный продукт подвергается декарбоксилированию с отщеплением СО2; кофермент остается в форме a-оксиэтильного производного — соединения, представляющего активированную или связанную с ко-ферментом форму ацетальдегида. На последней стадии оксиэтильная группа отделяется от кофермента в виде свободного ацетальдегида, что приводит к регенерации свободного комплекса фермент-ТПФ. Тиаминпирофосфат служит переносчиком активных альдегидных групп точно так же, как АТФ служит переносчиком активных фосфатных групп. На заключительной стадии спиртового брожения ацетальдегид восстанавливается до этанола под действием фермента алкогольдегидрогеназы, коферментом которой является НАД; роль восстановителя играет при этом НАД • Н + Н+:
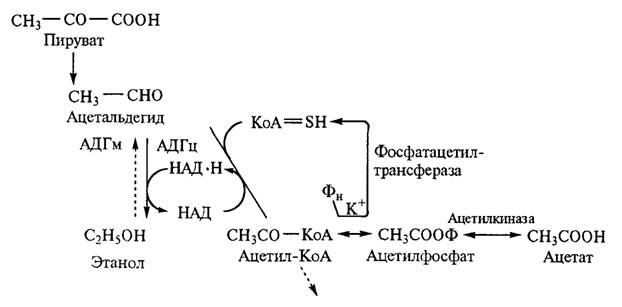
В дрожжах обнаружены две группы алкогольдегидрогеназ: растворимая АДГ и АДГ, связанная с мембранными структурами, локализованными в митохондриях. Цитоплазматическая алкогольдегидрогеназа (АДГц) превращает ацетальдегид в этанол, а митохондриальная (АДГм), наоборот, окисляет этанол в ацетальдегид (рис. 2.14). В дальнейшем ацетил-КоА окисляется в цикле трикарбоновых кислот или преобразуется в свободный ацетат.
Рис. 2.13. Декарбоксилирование пирувата
Рис. 2.14. Механизм окислительно-восстановительного превращения дрожжами в аэробиозе ацетальдегида в этанол и ацетат Суммарное уравнение спиртового брожения выражается в следующем виде: С6Н12О6 + 2Фн + 2АДФ → 2СН3СН2ОН + 2СО2 + 2АТФ. Таким образом, процесс спиртового брожения состоит в превращении одной молекулы D-глюкозы в две молекулы этанола и двух молекул АДФ в две молекулы АТФ; от глицеральдегид-3-фосфата к пирувату переносятся четыре электрона в форме 2НАД • Н + 2Н+. Реакции, обеспечивающие выделение энергии, сохраняют ее в форме АТФ, при спиртовом брожении и гликолизе они идентичны. |
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 1583. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |