Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Визначення вмісту дихлораміну⇐ ПредыдущаяСтр 13 из 13 До відтитрованого розчину після визначення вмісту монохлораміну знову додають близько 1 г йодиду калію, перемішують до розчинення солі і залишають розчин стояти протягом 2 хв. Поява рожевого забарвлення свідчить про наявність у воді дихлораміну. Розчин титрують стандартним розчином солі Мора до зникнення забарвлення. Витрата солі Мора (С, мл) відповідає вмісту дихлораміну, мг/л. Обробка результатів.Вміст сумарного залишкового активного хлору (Х3), мг/л, обчислюють за формулою Х3 = А + В + С , де А − вміст вільного хлору, мг/л; В − вміст монохлораміну, мг/л; С − вміст дихлораміну, мг/л.
ЛАБОРАТОРНА РОБОТА № 9 Визначення вмісту у воді Сірководню і сульфідів У поверхневих водах суходолу, особливо в придонних шарах зі слабким водообміном та дефіцитом кисню, сірководень і сульфіди утворюються внаслідок біохімічної деструкції органічних речовин природного походження. Значні кількості сірководню і сульфідів можуть потрапляти в природні води зі стоками нафтопереробних заводів, комунально-побутовими, сільськогосподарськими стічними водами тощо. Концентрація сірководню в природних водах може швидко зменшуватись унаслідок окиснення розчиненим у воді киснем, а також перебігу мікробіологічних процесів. При цьому утворюються в основному сірка та сульфати. Сірководень − це дуже токсична сполука з неприємним запахом, що погіршує органолептичні властивості води і робить її непридатною для пиття та технічного водопостачання. У водоймах санітарно-побутового й рибогосподарського використання неприпустима наявність сірководню. Сірководень міститься у воді у вигляді молекул Н2S, гідросульфід-іонів HS- і значно рідше − у вигляді сульфід-іонів S2-. Співвідношення між цими формами залежить від значення рН води (табл. 9.1). За рН < 10 вмістом іонів S2- можна знехтувати.  Таблиця 9.1. Відносний вміст форм сірководню за різних значень рН води
Серед методів визначення малих концентрацій сірководню і сульфідів у природних водах найбільш чутливими, простими і специфічними є фотометричні.
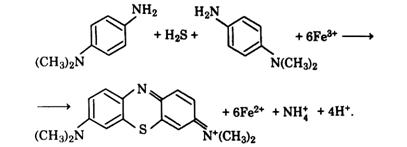
Фотометричне визначення з диметилпарафенілендіаміном Принцип методу. Фотометричне визначення сірководню та сульфідів ґрунтується на їх здатності утворювати з диметилпарафенілендіаміном у кислому середовищі безбарвну лейкооснову, яка іонами заліза(ІІІ) окиснюється з утворенням забарвленої метиленової сині:
Для забезпечення перебігу цієї реакції за допомогою сірчаної кислоти потрібно створити рН ~0,5. Лінійна залежність оптичної густини розчину за 667 нм від концентрації сірководню й сульфідів зберігається в межах 0 − 1,0 мг Н2S/дм3. Нижня межа визначення становить 0,05 мг Н2S/дм3 за об'єму проби 100 см3. Визначенню заважають відновники Методика визначення. Пробу води на місці відбирання наливають у склянку місткістю 100 см3 з притертою пробкою за допомогою сифона, зануреного до дна склянки. Впродовж деякого часу воду продовжують пропускати у склянку, щоб витіснити перші її порції. Наповнивши склянку водою, піпетками вносять 2,5 см3 робочого розчину диметилпарафенілендіаміну і 2,5 см3 розчину хлориду заліза(ІІІ). Кінчик піпетки занурюють до половини висоти стовпа рідини в склянці і виймають його в міру витікання рідини. Після внесення реактивів склянку закривають пробкою, перемішують її вміст і залишають у темному місці. Визначення проводять через 30 хв, але не пізніше, ніж через 2−3 год. Оптичну густину розчину вимірюють на спектрофотометрі за 667 нм або на фотоелектроколориметрі з червоним світлофільтром у кюветі з товщиною поглинального шару 5 см відносно дистильованої води. Вміст сірководню і сульфідів у мг Н2S/дм3 визначають за калібрувальним графіком. Якщо оптична густина розчину виходить за межі калібрувального графіка, то для аналізу беруть менший об'єм проби води і доливають дистильованою водою до 100 см3. Побудова калібрувального графіка. У мірні колби місткістю по 200 см3 наливають 0; 1,0; 2,5; 5,0; 10,0; 20,0 см3 робочого розчину сірководню концентрацією 0,01 мг Н2S/см3 і доливають до риски. Концентрації отриманих розчинів дорівнюють відповідно 0; 0,050; 0,125; 0,250; 0,500 і 1,000 мг Н2S/дм3. Далі аналіз продовжують за вищеописаною методикою. Оптичну густину розчинів вимірюють відносно дистильованої води, будують калібрувальний графік, відкладаючи на осі абсцис значення концентрації сульфіду (мг Н2S/дм3), а на осі ординат — значення оптичної густини. Сумарну концентрацію сірководню і сульфідів Сх (мг Н2S/дм3) обчислюють за рівнянням
де С — концентрація Н2S, визначена за калібрувальним графіком, мг Н2S/дм3; V— об'єм проби води, см3.
Апаратура Спектрофотометр або фотоелектроколориметр (λ = 667 нм, червоний світлофільтр). Реактиви Розчин диметилпарафенілендіаміну солянокислого Н2NС6Н4N(СН3)∙2НСl, основний: 5 г диметилпарафенілендіаміну розчиняють у розчині сірчаної кислоти (1 : 1) і доводять об'єм у мірній колбі до 25 см3 таким самим розчином кислоти. Розчин диметилпарафенілендіаміну солянокислого робочий: основний розчин реагенту (25 см3) розбавляють розчином сірчаної кислоти (1 : 1) до 1 дм3. Розчин хлориду заліза(ІІІ): 5 г FеС13∙6Н20, х.ч., розчиняють у бідистильованій воді, об'єм розчину доводять у мірній колбі до 100 см3. Розчин дихромату калію, 0,02 моль-екв/дм3: 0,980 ± 0,001 г К2Сr2О7, х.ч., висушеного при 180− 200 °С упродовж 1,5−2 год, розчиняють у дистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі. Розчин тіосульфату натрію Nа2S2O3∙5Н20, 0,02 моль-екв/дм3: 2,5 г Nа2S2О3·5Н2О розчиняють в 1 дм3 дистильованої води, яку попередньо кип'ятять упродовж 1,5 год і охолоджують до кімнатної температури. Зберігають у склянці з темного скла. Концентрацію розчину перевіряють щотижня. Для цього в конічну колбу місткістю 250 см3 наливають приблизно 100 см3 дистильованої води, всипають 1 г сухого КІ, після його розчинення добавляють піпеткою точно 15 см3 розчину К2Сr2О7 концентрацією 0,02 н і 5 см3 Н2SО4 (1 : 4). Ретельно перемішують і титрують розчином тіосульфату натрію до появи світло-жовтого забарвлення. Після цього добавляють 1 см3 розчину крохмалю і продовжують титрувати до зникнення синього забарвлення. Концентрацію тіосульфату С1 (моль-екв/дм3) обчислюють за рівняннм
де С2 − концентрація розчину К2Сr2О7, моль-екв/дм3; V2 − об'єм розчину дихромату калію, взятий на титрування, см3; V1 — об'єм розчину тіосульфату натрію, витрачений на титрування, см3. Розчин крохмалю, 0,5%-й. Розчин сірчаної кислоти (1 : 1): 500 см3 концентрованої Н2SO4, х.ч., обережно вливають у 500 см3 бідистильованої води за постійного перемішування суміші. Розчин використовують після остигання. Розчин сірководню основний, 0,1 мг Н2S/дм3: приблизно 0,1 г кристалів Nа2S∙9Н20 промивають водою для видалення слідів сульфатів і віджимають між аркушами фільтрувального паперу. Отриманий препарат розчиняють у 50 см3 бідистильованої води і добавляють 50 см3 гліцерину. Точний вміст сульфідів у цьому розчині в розрахунку на Н2S визначають йодометричним методом і розчин розбавляють бідистильованою водою так, щоб в 1 дм3 було 0,1 мг Н2S. Для визначення точного вмісту сульфідів у колбу місткістю 100 см3 з притертою пробкою піпеткою вносять 10 см3 розчину Na2S 9Н2О, добавляють 20 см3 розчину йоду концентрацією 0,01 моль-екв/дм3, 10 см3 НС1 (1 : 1), закривають пробкою, струшують і залишають у темному місці на 10 хв. Потім надлишок йоду відтитровують розчином тіосульфату натрію до появи блідо-жовтого забарвлення, добавляють 2 см3 0,5%-го розчину крохмалю і дотитровують до зникнення синього забарвлення. Вміст сульфідів Сх (мг Н2S/дм3) обчислюють за рівнянням
де V — об'єм розчину, взятий для титрування, см3; V1 — об'єм розчину добавленого йоду, см3; С1 — концентрація розчину добавленого йоду, моль-екв/дм3; V2 — об'єм розчину тіосульфату натрію, витраченого на титрування, см3; С2 — концентрація розчину тіосульфату натрію, витраченого на титрування, моль-екв/дм3; 17 — молярна маса еквівалента сірководню. Розчин сірководню робочий, 0,01 мг Н2S/дм3: 10 см3(або інший об'єм залежно від концентрації Сх) основного розчину розбавляють бідистильованою водою і доводять об'єм у мірній колбі до 100 см3. Робочий розчин готують безпосередньо перед будуванням калібрувального графіка для визначення вмісту сірководню і сульфідів. Розчин йоду, 0,01 моль-екв/дм3: 4 − 5 г КІ розчиняють у бідистильованій воді, добавляють 1,23 г кристалічного йоду і після його розчинення доводять об'єм розчину в мірній колбі до 1 дм3. Концентрацію розчину йоду Сх (моль-екв/дм3) встановлюють титруванням розчином тіосульфату натрію з крохмалем як індикатором і обчислюють за рівнянням
де V1 — об'єм розчину тіосульфату натрію, витрачений на титрування, см3; С1 — концентрація розчину тіосульфату натрію, витраченого на титрування, моль-екв/дм3; V2 — об'єм розчину йоду, взятий для титрування (10 см3). Можна використовувати розчин йоду, приготовлений із фіксаналу. Розчин соляної кислоти (1:1): концентровану НС1 (х.ч., d=1,19 г/см3) розбавляють бідистильованою водою у співвідношенні 1 : 1 (за об'ємом).
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 358. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||
 і
і  (концентрацією понад 10 мг/дм3) та
(концентрацією понад 10 мг/дм3) та 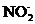 (концентрацією понад 10 мг N/дм3), які трапляються тільки в дуже забруднених водах. Впливу відновників можна позбутися, збільшивши концентрацію хлориду заліза(ІІІ).
(концентрацією понад 10 мг N/дм3), які трапляються тільки в дуже забруднених водах. Впливу відновників можна позбутися, збільшивши концентрацію хлориду заліза(ІІІ).