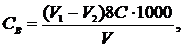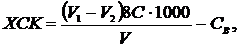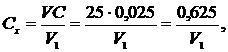Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
РОЗДІЛ 3. Органічнічні сполукиОрганічні сполуки є обов'язковими компонентами природних вод. Від їх якісного та кількісного складу значною мірою залежить життєдіяльність водяних організмів − гідробіонтів, які відіграють важливу роль у формуванні якості води. У поверхневих водах суходолу органічні речовини містяться в розчиненому, колоїдно-дисперсному стані та входять до складу зависей. їх можна розділити методом мембранної фільтрації. У рутинних гідрохімічних аналізах розрізняють вміст розчинених органічних речовин, які визначають у пробі, профільтрованій крізь мембранний фільтр із розміром пор 0,45 мкм, а також загальний вміст органічних сполук, який визначають у нефільтрованій пробі. За різницею між цими величинами розраховують вміст органічних речовин у зависях. Методики визначення органічних речовин можна розподілити на три групи. До першої належать методики, які полягають у визначенні певних показників, що характеризують сумарний вміст органічних речовин без розшифровування їх компонентного складу: визначення хімічного споживання кисню (ХСК, дихроматна окиснюваність(ДО)), перманганатної окиснюваності (ПО), біохімічного споживання кисню (БСК), вуглецю органічних сполук (Сорг). До цієї групи можна віднести також методики визначення азоту та фосфору органічних сполук (Nорг та Рорг). Величина ХСК адекватна загальному вмісту органічних сполук, а величина ПО — вмісту найбільш доступних для гідробіонтів органічних сполук, що легко окиснюються. Відношення ПО/ДО завжди менше за одиницю і змінюється в різні пори року залежно від життєдіяльності гідробіонтів. Методики визначення цих показників − титриметричні та фотометричні − найпростіші, вони ввійшли у практику гідрохімічних моніторингових досліджень.  Другу групу становлять в основному фотометричні та електрохімічні методики визначення вмісту окремих груп органічних сполук − гумусових речовин, амінів, амінокислот, органічних кислот, нафтопродуктів тощо. Нарешті, використовуючи в основному екстракційно-, сорбційно-хроматографічні, а також оптичні методики, визначають третю групу речовин − індивідуальні органічні сполуки, такі як пестициди, феноли, сечовина та інші речовини природного чи антропогенного походження.
Лабораторна робота № 6 Хімічне і біохімічне споживання кисню
Хімічне споживання кисню (ХСК) Принцип методу. Органічні речовин природних вод практично повністю окиснюють надлишком дихромату калію в сірчанокислому середовищі під час кип'ятіння за наявності каталізатора Аg2SO4: Сr2O72- + 6е- + 14Н+ → 2Сr3+ + 7Н2O. Залишок дихромату після окиснення органічних речовин визначають, титруючи розчином солі заліза(ІІ): Сr2O72- + 6Fе2+ +14Н+ → 2Сr3+ + 6Fе3+ +7Н2O. За різницею між кількостями введеного та визначеного дихромату розраховують його кількість, витрачену на окиснення органічних речовин, і виражають у мг О/дм3, користуючись при розрахунках молярною масою еквівалентe кисню. ХСК визначають у свіжовідібраних пробах води. Якщо це неможливо, то проби консервують додаванням 1 см3 Н2SO4 (1: 3) до 1 дм3 води. Визначенню ХСК заважають хлориди, сульфіди, сульфіти, нітрити, залізо(ІІ) та інші неорганічні відновники. Всі ці речовини, крім хлоридів, зазвичай містяться в поверхневих водах у незначних кількостях. Їх враховують попереднім титруванням проби води дихроматом калію в сірчанокислому середовищі на холоді. Для цього в конічну колбу місткістю 250 см3 вносять 20 см3або менший об'єм проби, доведений до 20 см3 бідистильованою водою, добавляють 10 см3 0,025 моль-екв/дм3 розчину дихромату калію, 100 см3 бідистильованої води, 30 см3 концентрованої сірчаної кислоти й охолоджують. Потім добавляють 15 крапель розчину індикатору N-фенілантранілової кислоти і надлишок дихромату, який не прореагував, титрують 0,025 моль-екв/дм3 розчином солі Мора до зміни забарвлення розчину від фіолетового до синьо-зеленого. Одночасно проводять «холостий» дослід з бідистильованою водою. Вміст відновників Св (мг О/дм3 ) обчислюють за рівнянням
де V1 − об'єм розчину солі Мора, витрачений на титрування «холостої» проби, см3; V2 − об'єм розчину солі Мора, витрачений на титрування проби води, см3; С − концентрація розчину солі Мора, моль-екв/дм3; V − об'єм проби води, см3; 8 — молярна маса еквівалента кисню (M 1/2 O). Значення вмісту відновників Св віднімають від результату визначення ХСК проби. Якщо Св ≤ 0,1 мг О/дм3, то наявністю неорганічних відновників можна знехтувати. Вплив хлоридів, що заважають аналізу, усувають зв'язуванням їх у малодисоційовану сполуку НgСІ2, як описано в методиці визначення.
Стандартний дихроматний метод Методика визначення. У круглодонну колбу зі шліфом місткістю 250 см3 вносять 20 см3 проби (або менший об'єм, доведений до 20 см3 бідистильованою водою), добавляють 10 см3 0,025 моль-екв/дм3 розчину дихромату калію, 100 мг Н2SO4 на кожні 10 мг хлоридів, концентрації яких менші за 1 г/дм3 (якщо концентрація хлоридів понад 1 г/дм3, добавляють 15-разовий надлишок концентрованої H2SO4 обережно доливають 30 см3 розчину сульфату срібла в концентрованій сірчаній кислоті й кладуть кілька кип'ятильних камінців для забезпечення рівномірності кипіння. Колбу з'єднують зі зворотним холодильником і суміш кип'ятять упродовж 2 год. Після охолодження холодильник від'єднують і промивають його стінки 26 см3 бідистиляту. Вміст колби, споліскуючи її стінки 100 см3 бідистиляту, переливають у конічну колбу місткістю 750 см3 і знову охолоджують. Потім добавляють 15 крапель індикатору N-фенілантранілової кислоти і надлишок дихромату титрують 0,025 моль-екв/дм3 розчином солі Мора до зміни забарвлення розчину від фіолетового до синьо-зеленого, енергійно перемішуючи суміш. Одночасно проводять «холостий» дослід з бідистильованою водою. Величину ХСК (мг О/дм3) обчислюють за рівнянням
де V1 − об'єм розчину солі Мора, витрачений на титрування «холостої» проби, см3; V2 − об'єм розчину солі Мора, витраченої на титрування проби води, см3; С − концентрація солі Мора, моль-екв/дм3; V − об'єм проби води,см3; 8 − молярна маса еквівалента кисню; С − вміст неорганічних відновників, мг О/дм3. Примітка. Після кип'ятіння проби з дихроматом калію залишок останнього не повинен становити менш ніж 30 − 40 % кількості введеного. Якщо дихромату залишилося менше, то аналіз повторюють з меншим об'ємом проби. Нижня межа визначення становить 5 мг О/дм3 за об'єму проби 20 см3 і різниці (V1-V2) = 0,5 см3. За значенням ХСК можна приблизно розрахувати вміст органічного вуглецю, мг С/дм3, використовуючи коефіцієнт 0,375, який дорівнює відношенню атомної маси вуглецю (12) до молекулярної маси кисню (32) Сорг ≈ 0,375ХСК. Реактиви Сірчана кислота Н2SO4 , х.ч., концентрована. Розчин сірчаної кислоти (1 : 1): до 50 см3 бідистильованої води невеликими порціями за перемішування добавляють 50 см3 концентрованої сірчаної кислоти. Розчин сульфату срібла в концентрованій сірчаній кислоті: 13 г Ag2SО4, ч.д.а., розчиняють в 1 дм3 концентрованої сірчаної кислоти. Розчин їдкого натру, 0,1 М: 0,1 г NаОН, ч.д.а., розчиняють у 25 см3 бідистильованої води. Сульфат ртуті HgSO4, ч.д.а. Розчин індикатору N-фенілантранілової кислоти: 0,25 г N-фенілантранілової кислоти C13H11O2N розчиняють у 12 см3 0,1 М розчину NaOH і розбавляють бідистильованою водою до 250 см3. Розчин дихромату калію, 0,25 моль-екв/дм3: 12,258 ± 0,001 г К2Сr2О7, х.ч., попередньо висушеного упродовж 2 год при 105 °С, розчиняють у бідистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі. Розчин дихромату калію, 0,025 моль-екв/дм3: 100 см3 0,025 моль-екв/дм3 розчину дихромату калію розбавляють бідистильованою водою до 1 дм3 у мірній колбі. Розчин солі Мора (залізоамонійного галуну), 0,25 моль-екв/дм3: 98,0 ±0,1 г Fe(NH4)2(SO4)2∙6H2O, ч.д.а., розчиняють у бідистильованій воді, добавляють 20 см3 концентрованої сірчаної кислоти, охолоджують і доводять об'єм розчину бідистильованою водою до 1 дм3 у мірній колбі. Розчин солі Мора, 0,025 моль-екв/дм3: 100 см3 0,25 моль-екв/дм3 розчину солі Мора розбавляють бідистильованою водою до 1 дм3 у мірній колбі. Точну концентрацію розчину встановлюють так: у конічну колбу місткістю 750 см3 наливають 25 см3 0,025 моль-екв/дм3 розчину дихромату калію, добавляють 175 см3 бідистильованої води, 15 см3 розчину сірчаної кислоти (1: 1), 15 крапель індикатору N-фенілантранілової кислоти і титрують розчином солі Мора до зміни забарвлення суміші від червоно-фіолетового до синьо-зеленого. Концентрацію розчину солі Мора Сх (моль-екв/дм3) обчислюють за рівнянням
де V − об'єм розчину дихромату калію, см3; С − його концентрація, моль-екв/дм3; V1 − об'єм розчину солі Мора, витрачений на титрування, см3.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 419. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |