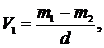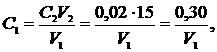Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Біохімічне споживання кисню (БСК)Для характеристики ступеню забруднення природних вод нестійкими органічними речовинами визначають інтенсивність біохімічного споживання кисню мікроорганізмами за певний час, який називають періодом інкубації. Об'єм кисню (мг О2/дм3), який витрачається на біохімічну деструкцію нестійких органічних речовин за стандартний період інкубації 5 діб при 20 °С у темряві, характеризує біохімічне споживання кисню − БСК5. Однак п'ятидобове біохімічне споживання кисню не є кількісним; для визначення повного БСК інкубацію потрібно проводити упродовж 15 − 20 діб залежно від біологічних характеристик заселеності природної води. Значення БСК5 у водоймах з різним ступенем забруднення органічними речовинами наведено у табл. 6.1. У поверхневих водах суходолу значення БСК5 коливається в межах 0,5 − 4 мг О2/дм3. Однак слід мати на увазі, що величина БСК є біохімічним, а не хімічним показником наявності органічних речовин у воді. Тому вона може бути низькою навіть за високих концентрацій органічних сполук, якщо вода забруднена неорганічними або органічними токсикантами, що пригнічують діяльність мікроорганізмів. Таблиця 6.1. Значення БCK5 у водоймах з різним ступенем забруднення
Принцип методу. Визначення БСК полягає у встановленні концентрації розчиненого у воді кисню відразу після відбирання проби та після її інкубації впродовж певного часу (зазвичай 5 діб, БСК5). Різниця між кількістю розчиненого кисню у свіжій пробі та у пробі води після інкубації (мг О2/дм3) і є біохімічним споживанням кисню.  Під час визначення БСК потрібно дотримуватись певних умов. Вміст кисню у первісній або розбавленій пробі води має залишатись упродовж інкубації таким, щоб забезпечити нормальні умови для перебігу аеробних біохімічних процесів. Цим умовам відповідає зниження вмісту кисню за час інкубації на 2 мг/дм3 або більше, однак залишкова концентрація кисню після інкубації має становити не менш ніж 2 мг О2/дм3. Для цього пробу попередньо насичують киснем збовтуванням її впродовж 1 хв. У разі малого вмісту кисню вимога мінімального його споживання − 2 мг О2/дм3 може не дотримуватись, проте його залишкова концентрація після інкубації має бути дотриманою. Якщо припускають, що БСК проби перевищує 6 мг О2/дм3, то пробу розбавляють спеціальним розчином (табл. 6.2.).
Таблиця 6.2. Рекомендоване розбавляння проб досліджуваної води при визначенні БСК
Пробу води відбирають у чисту суху склянку місткістю 1 − 1,5 дм3 так, щоб у ній не залишилося повітря, і склянку закривають. Пробу потрібно обробити негайно. Якщо це неможливо, її зберігають у холодильнику за температури 0 °С. Методика визначення. Спочатку визначають рН води. Якщо його значення виходить за межі інтервалу 6,0 − 8,0, то до 500 см3 води, профільтрованої крізь паперовий фільтр, добавляють розчин НС1 або NaОН до досягнення потрібної кислотності розчину за рН−потенціометричного контролю. Пробу нагрівають на водяній бані або охолоджують до 20 °С, збовтують упродовж 1 хв для насичення води киснем повітря і розливають у три кисневі склянки місткістю 100 − 150 см3. В одній з них негайно визначають концентрацію кисню за йодометричним методом Вінклера. Дві інші склянки закривають пробками так, щоб у них не залишалося бульбашок повітря, витримують упродовж 5 діб у непроникному для світла термостаті за температури 20 °С, після чого визначають залишкову концентрацію кисню, яка має становити не менш як 2 мг О2/дм3. Визначення концентрації кисню йодометричним методом Вінклера. Кисневу склянку 2−3 рази споліскують досліджуваною природною водою і заповнюють пробою води по вінця так, щоб на внутрішній поверхні склянки не залишилося бульбашок повітря. Потім у склянку окремими піпетками вносять 1 см3 розчину хлориду мангану та 1 см3 лужного розчину йодиду калію. Піпетку занурюють до половини висоти посудини і в міру витікання розчину піпетку підіймають. Потім посудину швидко закривають пробкою так, щоб не залишилося бульбашок повітря, і її вміст перемішують. При цьому утворюється осад гідроксиду мангану (II), який частково окислюється до бурого осаду МnО(ОН)2 розчиненим у воді киснем. Осад залишають відстоюватись не менше ніж 10 хв, але не довше, ніж на 1 добу. Потім піпеткою добавляють 5 см3 розчину сірчаної кислоти, зануривши її майже до поверхні осаду. В міру витікання розчину піпетку повільно підіймають так, щоб не скаламутити осад. Частина прозорого розчину, який при цьому виливається зі склянки, не впливає на результати аналізу. Посудину закривають пробкою і ретельно перемішують. При цьому йодид окислюється до йоду, а осад гідроксиду мангану розчиняється. Піпеткою відбирають 50 см3 розчину, переносять його у конічну колбу місткістю 250 см3 і − титрують тіосульфатом, доки розчин не набуде світло-жовтого забарвлення. Потім добавляють 1 см3 свіжоприготовленого розчину крохмалю і продовжують титрування до зникнення синього забарвлення. Вміст розчиненого кисню Сх (мг О2/дм3) обчислюють за рівнянням
де С − концентрація розчину тіосульфату натрію, моль-екв/дм3; V − об'єм розчину тіосульфату натрію, витраченого на титрування, см3; V1 − об'єм кисневої склянки, в яку відбирали воду, см3; 2 − об'єм води, що вилився під час фіксування розчиненого кисню, см3; М − молярна маса еквівалента кисню (M Калібрування кисневих склянок. Суху склянку з пробкою зважують з точністю до 0,01 г, заповнюють її по вінця дистильованою водою, закривають пробкою так, щоб не залишилося бульбашок повітря, витирають досуха і знову зважують. Об'єм склянки V1 (см3) обчислюють за рівнянням:
деm1 − маса склянки з водою, г;m2 − маса пустої склянки, г;d − густина води за температури зважування, г/см3 (за температур 15, 20 і 25 °С d відповідно дорівнює 0,998; 0,997 і 0,996 г/см3). Якщо після інкубації вміст кисню виявиться меншим, що свідчить про високе значення БСК проби, її перед інкубацією розбавляють спеціальним розчином (див. табл. 2).
Значення БСК5 (мг О2/дм3) обчислюють за рівнянням
де С0 і С5 − концентрації розчиненого кисню відповідно відразу після відбирання проби води та через 5 діб інкубації, мг О2/дм3; О2 − БСК5 розбавленої проби води, мг О2/дм3; Р − об'єм досліджуваної проби води в 1 дм3 її суміші зі спеціальним розчином для розбавляння, см3. Реактиви Реактиви, потрібні для визначення розчиненого у воді кисню: Розчин хлориду мангану(ІІ) МnСІ2·4Н2О або МnS04·4Н2О; Лужний розчин йодиду калію або натрію; розчин сірчаної кислоти (1 : 4); розчин крохмалю; розчин дихромату калію, 0,02 моль-екв/дм3 ; розчин тіосульфату натрію, 0,02 моль-екв/дм3. Концентрацію розчину тіосульфату перевіряють щотижня. Для цього в конічну колбу місткістю 250 см3 наливають приблизно 100 см3 дистильованої води, всипають 1 г сухого КІ, після його розчинення добавляють піпеткою точно 15 см3 розчину К2Сr2О7 концентрацією 0,02 н і 5 см3 Н2SО4 (1 : 4). Ретельно перемішують і титрують розчином тіосульфату натрію до появи світло-жовтого забарвлення. Після цього добавляють 1 см3 розчину крохмалю і продовжують титрувати до зникнення синього забарвлення. Концентрацію тіосульфату С1 (моль-екв/дм3) обчислюють за рівнянням
де С2 − концентрація розчину К2Сr2О7, моль-екв/дм3; V2 − об'єм розчину дихромату калію, взятий на титрування, см3; V1 − об'єм розчину тіосульфату натрію, витрачений на титрування, см3. Спеціальний розчин для розбавлення проби готують з використанням дистильованої води, насиченої киснем, і зберігають у пляшці з темного скла. До 1 дм3 води добавляють по 1 см3 розчинів, наведених нижче. 1. Фосфатний буферний розчин, рН 7,2: 0,85 г КН2РО4, х.ч., 2,18 г КНРО4, х.ч., 3,34 г Nа2НРO4∙7Н2O, х.ч., 0,17 г NH4Сl, х.ч., розчиняють у дистильованій воді й доводять об'єм розчину до 100 см3 у мірній колбі. 2. Розчин сульфату магнію: 2,25 г MgSO4∙7Н2O, х.ч., розчиняють у дистильованій воді й доводять об'єм розчину до 100 см3 у мірній колбі. 3. Розчин хлориду кальцію: 2,75 г безводного СаСl2, х.ч., розчиняють у дистильованій воді й доводять об'єм розчину до 100 см3 у мірній колбі. 4. Розчин хлориду заліза(ІІІ): 0,025 г FеСl3∙6Н2O, х.ч., розчиняють у дистильованій воді й доводять об'єм розчину до 100 см3 у мірній колбі. Розчин соляної кислоти, 0,1 М: у мірну колбу місткістю 1 дм3 вносять 8 см3 концентрованої НСl (ч.д.а., d = 1,19 г/см3) і доливають до риски дистильованою водою. Розчин гідроксиду натрію, 0,1 М: 4,0 г NаОН, ч.д.а., розчиняють у дистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі.
Лабораторна робота № 7 |
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 563. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 O2=8,00)
O2=8,00)