
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Визначення вмісту срібла дитизоновим (колориметричним) методомСуть методу. Метод заснований на утворенні забарвленої в жовтий колір сполуки срібла з дитизоном і подальшим вилученням дитизонату срібла в шар тетрахлориду вуглецю при рН 1,5 − 2,0. Колориметрування здійснюється шляхом стандартних серій за змішаним забарвленням. Чутливість методу складає (об’єм досліджуваної води 200 мл) 1 мкг/л. Реактиви. Приготування основного стандартного розчину азотнокислого срібла. 0,157 г AgNO3 х.ч. розчиняють в мірній колбі місткістю 1 л в невеликій кількості дистильованої води, підкислюють 2 - 3 краплями концентрованої азотної кислоти і об'єм розчину доводять водою до 1 л. 1 мл розчину містить 100 мкг Ag+. Приготування робочого стандартного розчину азотнокислого срібла. Розчин отримують шляхом розведення основного розчину 1 : 100, послідовнорозбавляючи в 10 і 100 разів. 1 мл розчину містить 0,1 мкг Ag+. Приготування 20 %-ого розчину аскорбінової кислоти. 20 г аскорбінової кислоти розчиняють у 80 мл дистильованої води. Приготування 0,01 %-ого розчину дитизону. 0,05 г очищеного дитизону переносять в мірну колбу місткістю 500 мл, розчиняють в невеликій кількості тетрахлориду вуглецю і після розчинення доводять ним до мітки. Приготування 0,0005 %-ого розчину дитизону. Розчин готують розведенням 0,01 %-ого розчину дитизону очищеним тетрахлоридом вуглецю. Приготування 0,2 н розчину трилону Б. 36 г двозаміщеної натрієвої солі етилендіамінтетраоцтової кислоти розчиняють в дистильованій воді і доводять до 1 л в мірній літровій колбі. Приготування 25 %-ого розчину персульфату амонію. 100 г персульфату амонію (NH4)2S2O8 розчиняють в 300 мл дистильованої води і очищують. Для цього розчин фільтрують у ділильну воронку, в яку попередньо додано кілька мілілітрів діетилдитіокарбамату свинцю (ДДК), розчиненого в тетрахлориді вуглецю, і енергійно струшують протягом 1 - 2 хв. Екстрагування ДДК свинцем повторюють до тих пір, поки органічний шар не стане безбарвним.  Приготування розчину діетилдитіокарбамату свинцю. У 50 - 100 мл дистильованої води розчиняють 0,10 г оцтовокислого свинцю РЬ(СН3СОО)2, додають 0,10 г розчиненого у воді діетилдитіокарбамату натрію. При цьому утворюється білий осад ДДК свинцю. Розчин з осадом переносять в ділильну воронку, додають 250 мл ССl4 і збовтують. Осад розчиняють у ССl4. Водний шар відкидають, а шар ССl4 відфільтровують через сухий фільтр у мірну колбу місткістю 500 мл. Доводять до мітки ССl4. Розчин стійкий протягом трьох місяців. Проведення аналізу. Об’єм проби води для визначення вмісту срібла не повинен бути меншим за 500 мл. Враховуючи можливість адсорбції срібла стінками ємності, проби рекомендується відбирати в пластикові ємності. Проби води консервують додаванням 5 мл азотної кислоти на 1 л проби. Визначенню заважають: мідь і ртуть. Хлориди в концентрації до 300 мг/л не заважають визначенню. Вплив міді усувається зв'язуванням в комплекс з трилоном Б, а ртуті (Hg2+) − відновленням до ртуті (Hg+). У якості відновника використовується аскорбінова кислота. Відновлення протікає в азотнокислому середовищі. Реакція відновлення (Hg2+ в Hg+) аскорбіновою кислотою протікає повільно. В якості каталізатора застосовують срібло (для досліджуваної води використовують 0,5 мкг стандартного розчину срібла). Одновалентна ртуть не заважає визначенню срібла. У конічну колбу місткістю 300 мл вносять 200 мл попередньо профільтрованої води, 10 мл очищеної сірчаної кислоти (1 : 1) і 1 мл 25 %-ого розчину персульфату амонію. Пробу кип'ятять 10 хв (рахуючи з моменту закипання), охолоджують водою і доводять об'єм проби у вимірювальному циліндрі двічі перегнанною дистильованою водою до об'єму 200 мл. Розчин переносять у ділильну воронку місткістю 250 - 300 мл, додають 5 мл 0,2 н розчину трилону Б, перемішують і додають з бюретки 2 мл 0,0005 %-ого розчину дитизону в тетрахлориді вуглецю, енергійно струшують 1 хв. Забарвлення дитизону в присутності срібла змінюється від зеленого до жовтого. Після відстоювання нижній пофарбований шар дитизонату срібла зливають в колориметричну пробірку з притертою пробкою, перемішують і порівнюють інтенсивність забарвлення зі шкалою зразків. Для приготування шкали стандартних розчинів в вимірювальні циліндри місткістю 250 мл вносять: 0,0 ; 2,0 ; 3,0 ; 5,0 ; 7,0 ; 10 мл робочого стандартного розчину азотнокислого срібла і доводять до 200 мл дистильованою водою. Отримують шкалу зразкових розчинів з вмістом 0,0 - 0,2 - 0,3 - 0,5 - 0,7 - 1,0 мкг Ag+ в 200 мл розчину. Розчини переносять у колби місткістю по 300 мл. У кожну колбу додають по 10 мл сірчаної кислоти (1 : 1) і 1 мл 25 %-ого розчину персульфату амонію. Далі аналіз продовжують , як описано вище. Шкала стійка протягом доби за умови зберігання її в темному місці. Якщо досліджувана вода містить ртуть, то необхідно усунути її вплив. Для цього в досліджувану воду, перенесену в ділильну воронку після руйнування органічних речовин персульфатом амонію, додають 2 краплі очищеної азотної кислоти (1 : 1), 0,5 мл азотнокислого срібла, що містить 1 мкг/мл Ag+ ( каталізатор), і 5 мл свіжоприготовленого 20 %-ого розчину аскорбінової кислоти. Розчин перемішують і залишають стояти на 20 - 30 хв. Далі аналіз продовжують , як описано вище. При визначенні результатів введені в пробу 0,5 мкг срібла віднімають. Обробка результатів. Вміст срібла (X), в мг/л визначають за формулою
де Допустиме розходження між повторними визначеннями − 25 відн. %.
Лабораторна робота №5 Визначення МІДі Основними джерелами надходження міді у поверхневі води суходолу є мідьвмісні гірські породи, стічні води підприємств хімічної і металургійної промисловості, шахтні води та альгецидні препарати, які використовують для знищення водоростей, зокрема синьозелених під час «цвітіння» води. У природних водах мідь міститься в основному у вигляді комплексних сполук з органічними речовинами (50 − 95 %) і меншою мірою з неорганічними лігандами, такими як ОН- (гідроксокомплекси) та СО32-. Частка іонів Сu2+, що не входять до складу комплексів, рідко перевищує 1− 2%. Вміст міді в природних незабруднених прісних водах коливається в межах 2 − 50 мкг/дм3. Комплексні сполуки міді з органічними речовинами реакційно інертні, тому при визначенні її загального вмісту попереднє руйнування таких комплексів є обов'язковим. Для визначення міді у природних водах використовують колориметричне визначення з диетилдитіокарбаматом натрію, екстракційно-фотометричний метод з діетилдитіокарбаматом свинцю, а також атомно-абсорбційний, полярографічний, інверсійно-вольтамперометричний та кінетичний методи. Мідь можна також визначити за допомогою високоефективної рідинної хроматографії та експресних тест-методик. Розчинені сполуки міді визначають у пробі природної води, профільтрованої крізь очищений мембранний фільтр з діаметром пор 0,45 мкм. Загальний вміст міді визначають у нефільтрованій пробі води. Вміст міді в зависях обчислюють як різницю між загальним її вмістом та вмістом розчинених форм або визначають експериментально після розчинення мембранного фільтра з осадом. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 392. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
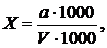
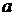 − вміст срібла, знайдений за шкалою стандартних розчинів, мкг; V − об'єм досліджуваної води, взятий для визначення, мл.
− вміст срібла, знайдений за шкалою стандартних розчинів, мкг; V − об'єм досліджуваної води, взятий для визначення, мл.