
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
РОЗДІЛ 1. фізичні властивості водиСтр 1 из 13Следующая ⇒ ФІЗИКО-ХІМІчні основи технології питної води Та очищення стічних ВОД
ЛАБОРАТОРНИЙ ПРАКТИКУМ для студентів за напрямом підготовки 6.051701 «Харчові технології та інженерія» денної форми навчання
КИЇВ НУХТ 2014
Фізико-хімічні основи технології питної води та очищення стічних вод: ЛАБОРАТОРНИЙ ПРАКТИКУМ для студентів за напрямом підготовки 6.051701 «Харчові технології та інженерія» ден. форми навч. / Уклад.: О.В. Грабовська, І.Б. Петриченко, О.М. Деменюк - К.: НУХТ, 2014. - с. 39.
Рецензент , д-р техн. наук, проф.
Укладачі: О.В. Грабовська, д-р техн. наук, проф. І.Б. Петриченко, кандидат техн.наук, доцент О.М. Деменюк, кандидат техн. наук
Відповідальний за випуск: О.М. Деменюк, канд.техн. наук
ВСТУП
Вода є найпоширенішим і в той же час незвичайною, дивною і далеко ще не розгаданою речовиною. Серед всіх речовин, що вивчаються фізиками та фізико-хіміками, вода у багатьох відношеннях є найважчою. Програма вивчення навчальної дисципліни “Фізико-хіміічні основи технології питної води та очищення стічних вод” за професійним спрямуванням “Технології питної води та водопідготовки харчових виробництв“ складена відповідно до освітньо-професійної програми підготовки бакалавра напряму “Харчові технології та інженерія”.  Предметом вивчення навчальної дисципліни є фізико-хімічні основи технології питної води, фізико-хімічні основи очищення стічних вод, показники якості води, шляхи, методи та способи визначення властивостей води та покращення її якості, способи одержання очищеної води. У результаті виконання лабораторного практикуму студент повинен: знати призначення і організацію хімічних лабораторій, методи відбору проб води; кваліфікацію методів аналізу, їх теоретичні основи і обґрунтування з погляду сучасних положень фундаментальних наук; правила техніки безпеки в хімічній лабораторій; вміти працювати з використовуваними для аналізу лабораторними приладами, настроювати їх; обчислювати отримані результати і визначити загальну похибку вимірювання; давати оцінку якості аналізованої проби з вимогами державного стандарту. З метою контролю знань студентів після кожного заняття проводиться колоквіум та перевірка оформлення протоколу. РОЗДІЛ 1. фізичні властивості води
ЛАБОРАТОРНА РОБОТА № 1 Каламутність, кольоровість і прозорість
1. Каламутність Каламутність води зумовлена наявністю в ній дрібнодисперсних і колоїдних речовин неорганічного та органічного походження − мулу, силіцієвої кислоти, гідроксидів заліза та алюмінію, органічних колоїдів, різноманітних мікроорганізмів, планктону. Принцип методу. Каламутність вимірюють методами турбідиметрії або нефелометрії порівнянням відповідно світлопоглинання чи світлорозсіювання проби зі стандартними суспензіями SіO2. Каламутність визначають у день відбирання проби, але не пізніше ніж через 1 добу після її відбирання. Зберігають пробу в темряві і, якщо потрібно, для гальмування біохімічних процесів у пробу добавляють 1−2 см3 хлороформу на 1 дм3 води. Турбідиметричне визначення. У кювету з відповідною товщиною поглинального шару вносять добре збовтану пробу води й відразу вимірюють оптичну густину на фотоелектроколориметрі з червоним світлофільтром. Якщо оптична густина поступово зменшується внаслідок осідання каламуті, то відмічають її максимальне значення. Розчином порівняння є дистильована вода. Аналізуючи забарвлені проби води, каламутність усувають центрифугуванням, від отриманого значення оптичної густини віднімають значення оптичної густини центрифугованої проби води. Каламутність проби води визначають за калібрувальним графіком і виражають у мг SіО2 г/дм3. Для побудови калібрувального графіка в кювету з такою самою товщиною поглинального шару послідовно наливають розчини суспензій SіO2, приготовлених за даними табл. 1.1., і вимірюють їх оптичні густини. Графік будують у координатах оптична густина − концентрація SіO2 (мг/дм3). Кювету підбирають так, щоб максимальна оптична густина не перевищувала 1,00. Таблиця 1.1. Дані для приготування розчинів SіO2 для побудови калібрувального графіка (загальний об'єм 100 см3)
Нефелометричне визначення. Вимірюють інтенсивність ефекту Тіндаля у відбитому світлі, що зумовлено наявністю у воді твердих часточок каламуті. Каламутність визначають за калібрувальним графіком аналогічно описаному вище способу. Апаратура Фотоелектроколориметр із червоним світлофільтром (А = 670 нм). Нефелометр. Кювети з товщиною поглинального шару 1−5 см. Реактиви Діоксид силіцію, стандартна суспензія: трепел, до складу якого не входить залізо, прожарюють, промивають дистильованою водою, висушують і знову прожарюють. Склад такого трепелу беруть за 100 % SіО2. Далі його розтирають в агатовій ступці, зважують 1,25 г, переносять у мірний циліндр і доливають 250 см3 дистильованої води. Суміш добре збовтують і залишають на 24 год, після чого обережно відбирають зверху 230 см3 суспензії. Для встановлення концентрації суспензії піпеткою відбирають 25 см3 її, переносять у чашку, маса якої відома, випарюють досуха, висушують при 105 °С і зважують. За різницею відповідних мас розраховують кількість SіО2 у мг/см3. Розбавлянням отриманої суспензії дистильованою водою готують стандартні суспензії з вмістом 1,0 і 0,1 мг SіO2 в 1 см3.
2. Кольоровість Кольоровість поверхневих вод суходолу зумовлена в основному наявністю в них забарвлених гумусових речовин та сполук заліза(ІІІ). У багатьох випадках колір води спричинений також вмістом у ній мікроорганізмів, часточок мулу, колоїдних сульфідів металів та інших нерозчинних речовин. Кольоровість визначають у профільтрованій або центрифугованій воді. Пробу води не консервують, а її кольоровість визначають не пізніше, ніж через 2 − 3 год після відбирання.
2.1. Визначення методом порівняння зі стандартними розчинами Принцип методу. Інтенсивність забарвлення води візуально порівнюють із забарвленням стандартних розчинів суміші хлороплатинату калію та хлориду кобальту або імітаційних стандартних розчинів суміші дихромату й сульфату кобальту. Забарвлення, яке відповідає кольору розчину, що містить 1 мг платини в 1 дм3, дорівнює одному градусу кольоровості. Методика визначення. У циліндри Несслера з плоским дном вносять 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 8,0; 10,0; 12,0 і 14,0 см3 стандартного розчину № 1 або імітуючого стандартного розчину № 2, об'єми розчинів доводять відповідно дистильованою водою або сірчаною кислотою (1:999) до 100 см3 і ретельно перемішують. Забарвлення отриманих розчинів відповідає забарвленню розчинів концентрацією 5 − 70 мг Pt/дм3, тобто кольоровості 5; 10; 15; 20; 25; 30; 40; 50; 60 і 70 град. Потім 100 см3 проби води наливають у такий самий циліндр Несслера і порівнюють інтенсивність забарвлення води зі стандартними розчинами, які розглядають зверху. Якщо інтенсивність забарвлення води виходить за межі шкали, то пробу розбавляють дистильованою водою, відмірюють 100 см3 у циліндр Несслера і проводять визначення з урахуванням кратності розведення.
Апаратура Циліндри Несслера місткістю 100 см3. Реактиви Стандартний розчин № 1, який містить 0,5 мг платини в 1 см3: у мірну колбу місткістю 1 дм3 вносять 1,245 ± 0,001 г К2РtСl6, х.ч., і 1,009 ± 0,001 г СоС12∙6Н20, х.ч., розчиняють у 100 см3 дистильованої води, добавляють 100 см3 концентрованої соляної кислоти, ч.д.а., і доливають дистильованою водою до риски. Кольоровість цього розчину дорівнює 500 град. Розчин стійкий упродовж одного року. Імітуючий стандартний розчин № 2, який відповідає вмісту 0,5 мг платини в 1 см3: у мірну колбу місткістю 1 дм3 вносять 0,0875 ± 0,0005 г К2Сг207, х.ч., і 2,000 ± 0,001 г СоS04∙7Н20, х.ч., розчиняють у дистильованій воді, добавляють 1 см3 концентрованої Н2S04, ч.д.а., і доливають дистильованою водою до риски.
2.2. Визначення методом колориметричного титрування Принцип методу. До дистильованої води добавляють стандартний забарвлений розчин доти, доки інтенсивність забарвлення розчину зрівняється з інтенсивністю забарвлення проби досліджуваної води. Методика визначення. В один циліндр Несслера наливають 100 см3 проби води, а в інший − 95 см3 дистильованої води. Якщо забарвлення води в циліндрах різне, то в циліндр із дистильованою водою із бюретки добавляють стандартний розчин суміші К2Сг207 і СоS04∙7Н20, перемішуючи вміст скляною паличкою, доки забарвлення в обох циліндрах не стане однаковим. Об'єм долитого стандартного розчину у мілілітрах, помножений на 20, дорівнює кольоровості води у градусах. Апаратура Циліндри Несслера місткістю 100 см3. Реактиви Стандартний розчин: 0,0875 ± 0,0005 г К2Сг207, х.ч., і 2,000 ± 0,001 г СоS04∙7Н20, х.ч., переносять у мірну колбу місткістю 250 см3, розчиняють у дистильованій воді, добавляють 2 см3 концентрованої сірчаної кислоти, х.ч., і доливають дистильованою водою до риски.
2.3. Фотометричне визначення Принцип методу. Кольоровість поверхневих вод суходолу здебільшого зумовлена їх світлопоглинанням в інтервалі довжин хвиль 340 − 400 нм. Фотометричне визначення кольоровості води полягає у вимірюванні її оптичної густини за довжини хвилі 340 (Д1) та 400 нм (Д2) й порівнянні з оптичними густинами розчинів стандартної дихроматно-кобальтової шкали, виміряними за таких самих довжин хвиль. Методика визначення. Профільтровану пробу води наливають у кювету з товщиною поглинального шару 1 см і вимірюють оптичну густину за 340 (Д1) і 400 нм (Д2) порівняно з дистильованою водою. Обчислюють різницю ΔД = Д1 − Д2, а кольоровість води (у градусах) визначають за відповідним калібрувальним графіком. Побудова калібрувального графіка. Як вихідний використовують імітуючий стандартний розчин № 2 (див. п..2.1). У мірних колбах місткістю 50 см3 готують розчини, як указано в табл. 3.2, і вимірюють їх оптичну густину за 340 (Д1) і 400 нм (Д2). Будують графік залежності ΔД = Д1 − Д2 від кольоровості (у градусах). Таблиця 1.2. Розчини для побудови калібрувального графіка для визначення кольоровості води (загальний об'єм 50 см3)
Апаратура Фотоелектроколориметр зі світлофільтрами 340 і 400 нм. Кювети з товщиною поглинальиого шару 1 см. Реактиви Імітуючий стандартний розчин № 2 (див. п. 2.1). Сірчана кислота, (х.ч., 1 :999); готують розбавлянням 1 см3 концентрованої Н2SO4 дистильованою водою до 1 дм3. 3. Прозорість Принцип методу. Прозорість води визначається їїкольоровістю та каламутністю. Мірою прозорості є висота водяного стовпа, крізь який ще можна спостерігати забарвлену в білий колір дощечку певного розміру або прочитати друкарський шрифт певного типу. Вимірювання за стандартною дощечкою. Прозорість води вимірюють на місці відбирання проби. Використовують білу квадратну дощечку розміром 20 х 20 см або білу круглу пластину діаметром 20 см. Вимірювання виконують за розсіяного денного світла із затіненого боку човна чи корабля. Дощечку, прикріплену до троса з відмітками довжини, занурюють у воду на глибину, за якої її перестае бути видно. Операцію повторюють 3−4 рази і записують середній результат (у сантиметрах). Вимірювання за допомогою шрифту. Аналіз виконують у лабораторних умовах. Під дно скляного прозорого циліндра, проградуйованого в одиницях довжини (у сантиметрах або міліметрах), підкладають білий папір із чорним шрифтом і добре освітлюють. Потім циліндр поступово заповнюють досліджуваною пробою води до такої висоти, коли літери, які розглядають зверху, почнуть погано розпізнаватись. Визначення повторюють кілька разів і знаходять середню висоту водяного стовпа у сантиметрах. Апаратура Скляний циліндр із внутрішнім діаметром 2,6 см і заввишки не менш як 50 см. Шрифт із розміром літер 3,5 мм.
Лабораторна робота № 2 питома електропровідність і окисно-відновний потенціал води Визначення питомої електропровідності Електропровідність поверхневих вод суходолу зумовлена в основному вмістом у них сольових компонентів (головних іонів), таких як Na+, К+, Са2+, Mg2+, HCO3-, СІ- і SО42-. Наявність інших іонів, зокрема Fe2+, Fe3+, Аl3+ та їхніх комплексних сполук, а також NH4+, NO2-, NO3, HPO42-, Н2РО4- та іонів деяких органічних сполук майже не коливає на електропровідність, оскільки вони рідко трапляються у воді в значних концентраціях. У воді з рН від 5 до 9 вміст іонів Н+ та ОН- малий, і їх вплив на електропровідність не перевищує 0,1 − 0,2 %. Абсолютну концентрацію головних іонів (мінералізацію води в мг/л) за електропровідністю визначити з достатньою надійністю неможливо через не однакову питому електропровідність розчинів різних солей. Питома електропровідність поверхневих вод суходолу є лише наближеним показником концентраціїелектролітів, здебільшого неорганічних, тобто ступеня мінералізації води. Водночас цей метод зручний для виявлення зміни ступеня мінералізації води під дією природних чи антропогенних чинників. Принцип методу. Електропровідність розчинів найчастіше вимірюють методом змінного струму з використанням електродів із великою площею поверхні («платинова чернь»), що забезпечує незначну поляризацію електродів і зменшує похибку вимірювання. Однак, якщо у досліджуваній воді містяться великі кількості поверхнево-активних речовин (жирів, смол, масел тощо), то доцільно брати електроди з гладенькою блискучою поверхнею. Розчини електролітів, як і всі провідники, характеризуються певним опором R. Одиницею опору є ом. Опір розчину прямо пропорційний відстані між електродами l і обернено пропорційний площі поверхні електродів S, яка занурена в розчин:
Коефіцієнт пропорційності Питома електропровідність æ — це величина, обернена до питомого опору: æ Одиницею питомої електропровідності є сименс на сантиметр (См/см, або 1/(Ом∙см)). З рівнянь (2.1) і (2.2) можна отримати рівняння для обчислення питомої електропровідності: æ Щоб визначити питому електропровідність розчину, крім його опору R потрібно знати величину l/S, яку неможливо точно визначити діленням відстані між електродами на площу їх поверхні, оскільки в електролітичній посудині (комірці), в якій вимірюється електропровідність, відбувається розсіювання силових ліній струму. При цьому велике значення має також форма комірки. Нарешті, справжню площу поверхні електродів важко визначити, особливо при їх платинуванні. Тому питому електропровідність розчинів обчислюють за рівнянням æ де К − константа електролітичної комірки, яку визначають експериментально (див. далі). Методика визначення. Електролітичну комірку споліскують кілька разів дистильованою водою і двічі досліджуваною пробою води. Потім пробу води наливають у комірку так, щоб електроди були вкриті повністю. Об'єм (рівень) води завжди має бути сталим. Електролітичну комірку ставлять у термостат, в якому підтримується температура 25,0 ± 0,1ºС. Після встановлення цієї ж температури в досліджуваному розчині вимірюють його опір за інструкцією, що додається до кондуктометра. Питому електропровідність проби води обчислюють за рівнянням (2.4). Визначення константи К електролітичної комірки. Електролітичну комірку споліскують 3−4 рази дистильованою водою, а потім 0,01 М розчином KCl. Наливають у комірку 0,01 М розчин KCl, ставлять у термостат, доводять його температуру до 25 ºС і вимірюють опір R. Розчин виливають з комірки, тричі споліскують її 0,1 М розчином KCl. Потім наповнюють комірку таким самим роачмом KCl. витримують у термостаті до встановлення температури 25 ºС і вимірюють опір розчину R. Константу електролітичної комірки обчислюють за рівнянням K = æR, врахувавши, що питомі електропровідності æ 0,01 М і 0,1 М розчинів KCl за 25 °С дорівнюють відповідно 0,001412 і 0,01289 См/см. Для двох розчинів KCl визначають середнє значення К. Для вимірювання питомої електропровідності поверхневих вод суходолу використовують електролітичні комірки, константи яких знаходяться в межах 0,8−1,5. Константи комірок, в яких містяться електроди, вкриті платиновою черню, треба перевіряти після кожних 200 вимірювань електропровідності, але не рідше ніж 1 раз на місяць, а константу комірок із блискучими електродами − після 500 − 600 вимірювань, але не рідше ніж 2 рази на рік. Апаратура Кондуктометр із комплектом електролітичних комірок. Реактиви Розчин хлориду калію, 0,1 М: 7,456 ± 0,001 г KCl, х.ч., розчиняють у дистильованій воді, об'єм розчину доводять у мірній колбі до 1 дм3. Розчин хлориду калію, 0,01 М готують розбавленням розчину 0,1 М у 10 разів дистильованою водою.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 399. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
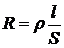 . (2.1)
. (2.1)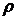 називають питомим опором. Якщо l = 1 см, S = 1 см2, то
називають питомим опором. Якщо l = 1 см, S = 1 см2, то 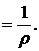 (2.2)
(2.2)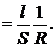 (2.3)
(2.3)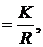 (2.4)
(2.4) (2.5)
(2.5)