
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Термодинамика дисперсных системМолекулы поверхностного слоя взаимодействуют как с молекулами одной фазы, так и с молекулами другой фазы, в результате чего равнодействующая молекулярных сил не равна нулю и направлена внутрь той фазы, с которой взаимодействие больше. Таким образом, возникает поверхностное натяжение Поверхностное натяжение можно представить как энергию переноса молекул из объёма тела на поверхность:
Отсюда следует, что поверхностное натяжение есть энергия Гиббса, приходящаяся на единицу поверхности. Поскольку поверхностное натяжение определяется энергией, приходящейся на единицу площади, его единицами измерения являются Дж·м−2 = Н·м−1. В настоящее время не существует строгих методов определения удельной поверхностной энергии на границе твердого тела, т.е. sгт и sжт, поэтому чаще прибегают к косвенным методам, основанным на определении работы межмолекулярных сил в соприкасающихся фазах, зависящей от величины соответствующих s. К ним относятся работа когезии и работа адгезии. Силы когезии – это силы межмолекулярного взаимодействия внутри одной фазы, а работа когезии (Wc) – та работа, которую надо затратить на разрыв однородной объемной фазы, отнесенная к единице площади разрыва. Для жидкости, окруженной газовой фазой, величину работы когезии вычисляют по формуле: Wc = 2sгж. Силы адгезии – это силы взаимодействия между молекулами, находящимися в разных фазах, а работа адгезии (Wa) – работа, которую надо затратить на разрыв двух соприкасающихся фаз, также отнесенная к единице площади разрыва. Для поверхности «твердое – жидкость», для которой разрыв двух соприкасающихся фаз приводит к образованию новых поверхностей этих фаз с газообразной средой, работу адгезии вычисляют по формуле:  Wa = sгт + sгж – sжт. Для поверхности «жидкость (1) – жидкость (2)» при тех же условиях разрыва:
Удельная поверхностная энергия (или поверхностное натяжение) на границе неассоциированной жидкости с воздухом или собственным паром, с увеличением температуры уменьшается. При температурах, далеких от критической (т.е. Т << Ткр), зависимость s = f(T) является линейной и подчиняется уравнению: s2 = s1 - g·(Т2 – Т1), где: g – температурный коэффициент поверхностного натяжения, практически не зависящий от температуры Т; s1 и s2 – поверхностное натяжение, соответственно, при температурах Т1 и Т2. Для определения температурной зависимости поверхностного натяжения (удельной поверхностной энергии) можно воспользоваться также уравнением Этвеша:
где: s – поверхностное натяжение (н/м или Дж/м2) при температуре Т; K – коэффициент Этвеша; М – молярная масса жидкости, г/моль; d – плотность жидкости при температуре Т, г/см3; Ткр – критическая температура. Смачивание – это явление, наблюдаемое на границе раздела трех соприкасающихся фаз и характеризующееся краевым углом смачивания. Линия, все точки которой принадлежат одновременно всем трём фазам, называется периметром смачивания. Краевой угол смачивания и – равновесный угол, образованный поверхностью твердой фазы и касательной к поверхности двух других соприкасающихся фаз в точке, принадлежащей периметру смачивания. Наибольшее практическое значение явление смачивания имеет на границе «твердое–жидкость–газ» (флотация, капиллярные явления и др.). Для этого случая уравнение Дюпре–Юнга:
где Wa – работа адгезии на границе «твердое–жидкость». Краевой угол смачивания измеряется через жидкую фазу и определяется по уравнению Юнга:
Явление смачивания приводит к искривлению поверхности раздела на границах «газ-жидкость», что является причиной капиллярных явлений. Суть капиллярных явлений заключается в том, что давление в двух объемных фазах, разделённых искривлённой поверхностью, в состоянии равновесия различно, причём, независимо от агрегатного состояния фаз, давление с вогнутой стороны поверхности раздела всегда больше, чем с выпуклой. Возникающая разность давлений DР называется капиллярным давлением. DР = Рa – Рb, где Рa – давление в фазе с вогнутой стороны поверхности раздела; Рb – давление в фазе с выпуклой стороны поверхности раздела. Капиллярное давление зависит от радиуса кривизны (R) поверхности раздела фаз и вычисляется по уравнению Лапласа–Юнга, которое для поверхности с постоянным радиусом кривизны (сфера или сферический сегмент) имеет вид: DР = 2s/R, а для эллипсоидной поверхности с главными радиусами кривизны R1 и R2 DР = s(1/R1 + 1/R2). Важным следствием явления смачивания и наличия капиллярного давления является поднятие (или опускание) жидкости, граничащей с газообразной фазой и находящейся в капилляре, т.е. узкой трубке из твёрдого материала, опущенной в объём жидкой фазы. Высоту поднятия (или опускания) жидкости в капилляре определяют по уравнению Жюрена:
где r – радиус капилляра; м; g = 9,81 м/с2; dж и dг – плотность жидкой и газообразной фазы, соответственно, кг/м3. Если материал капилляра является частично гидро(лио)фильным (cosθ > 0), то h > 0 и имеет место поднятие жидкости в капилляре. Если материал капилляра частично гидро(лио)фобен (cosθ < 0), то h < 0 и имеет место опускание жидкости в капилляре. Адсорбция |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 373. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
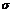 , стремящееся сократить поверхность.
, стремящееся сократить поверхность. или как работу образования единицы поверхности:
или как работу образования единицы поверхности:  . Поверхностное натяжение – это частная производная от энергии Гиббса по величине межфазной поверхности (при постоянных температуре, давлении и количестве вещества компонентов):
. Поверхностное натяжение – это частная производная от энергии Гиббса по величине межфазной поверхности (при постоянных температуре, давлении и количестве вещества компонентов): .
. .
. ,
, ,
, .
. ,
,