Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Карбоновые кислоты алифатического ряда и их производныеКарбоновые кислоты - это соединения, в которых функциональной группой является карбоксильная группа -СООН. При взаимодействии карбоновых кислот с металлами или гидроксидами металлов образуются соли (см. табл. 10.4). По физическим свойствам карбоновые кислоты представляют собой жидкости или твердые вещества. Присутствие карбоксильной группы увеличивает растворимость вещества в воде по сравнению со спиртами и альдегидами. Низкомолекулярные карбоновые кислоты хорошо растворимы в воде. В карбоновых кислотах содержится ОН-кислотный центр, поэтому в растворах происходит их ионизация:
Карбоновые кислоты - слабые кислоты. Константы кислотной ионизации большинства органических кислот находятся в пределах 1,4х10-5-1,0х10-4. Степень ионизации зависит от величины и характера радикала, связанного с карбоксильной группой. С увеличением длины алкильного радикала, обладающего электронодонорными свойствами, константа ионизации кислоты уменьшается (сила кислоты падает). Карбоновые кислоты могут содержать несколько карбоксильных групп. Например, дикарбоновые кислоты щавелевая (этандиовая) НООС-СООН и янтарная (бутандиовая) НООССН2СН2СООН содержат 2 карбоксильные группы. С щелочами карбоновые кислоты образуют соли. Соли щелочных металлов хорошо растворимы в воде. Соли в водных растворах диссоциируют на ионы, которые можно обнаружить с помощью различных реактивов. С солями тяжелых металлов многие карбоновые кислоты образуют окрашенные осадки. Со спиртами карбоновые кислоты образуют сложные эфиры, имеющие характерный запах. В медицинской практике чаще применяют не сами кислоты, а их соли и эфиры.  Известны различные гетерофункциональные соединения, которые содержат кроме карбоксильной и другие функциональные группы. К ним относятся гидроксикислоты и аминокислоты. Таблица 10.4. Лекарственные средства - производные алифатических карбоновых кислот
Продолжение табл. 10.4 Лекарственные средства - производные алифатических карбоновых кислот
Окончание табл. 10.4
Гидроксикислотаминазывают соединения, в молекулах которых содержатся гидроксильная и карбоксильная группы. Появление гидроксигруппы, обладающей положительным индуктивным эффектом, приводит к увеличению силы кислоты. Например, молочная кислота более сильная, чем пропионовая. Их константы ионизации равны 1,3х10-5 и 1,5х10-4 соответственно. Это связано с электронодонорными свойствами заместителя в молекуле молочной кислоты:
Гидрокситрикарбоновая кислота - лимонная - применяется в медицине в виде натриевой соли, натрия цитрата. В молекуле лимонной кислоты содержится 3 карбоксильных и 1 гидроксигруппа:
Гидроксикислоты могут подвергаться внутримолекулярной этерификации с образованием лактонов. Лактоны- соединения, в которых сложноэфирная группировка -C(O)O включена в циклическую структуру. Примером лактона является аскорбиновая кислота (витамин С) (см. табл. 10.4). Аминокислотаминазывают гетерофункциональные соединения, молекулы которых содержат одновременно амино- и карбоксильную группы. В зависимости от местоположения аминогруппы по отношению к карбоксильной группе аминокислоты алифатического ряда делят на группы. Если аминогруппа находится в а-положении, то это а-аминокислоты (2-аминокислоты) общей формулы:
6-Аминогексановая (аминокапроновая) кислота, H2N-CH2-(CH2)4COOH, применяется как ЛС. Аминокислоты как структурные единицы пептидов и белков играют важную роль в биологических процессах. Из белковых гидролизатов получено более 20 а-аминокислот. Аминокислоты условно называют заменимыми, если они синтезируются в организме человека. «Незаменимые» аминокислоты не синтезируются в организме человека или синтезируются в недостаточном количестве («частично заменимые») и должны пополняться с пищей. Представителем подобных кислот является, например, метионин. Все природные аминокислоты, кроме глицина (H2N-CH2- COOH) и ω-аминокислот, в которых аминогруппа находится на конце углеродной цепи, содержат хиральный центр и существуют в виде стереоизомеров (оптических, конфигурационных изомеров). Аминокислоты, входящие в состав белков животного происхождения, обычно являются L-изомерами. D-Аминокислоты входят в состав белка крайне редко. Так, D-глутаминовая кислота входит в состав белка клеточной стенки бактерии сибирской язвы. D-изомеры обнаружены также в некоторых природных антибиотиках (D-диметилцистеин в пенициллине, D-фенилаланин - в грамицидине). Аминокислоты алифатического ряда представляют собой белые кристаллические вещества, как правило, растворимые в воде и нерастворимые в органических растворителях. Все аминокислоты - амфолиты и способны реагировать как со щелочами, так и с минеральными кислотами. В водных растворах аминокислоты могут существовать в форме диполярных ионов (цвиттер-ионов): +NH3-CHR-COO- Значение рН, при котором существует диполярный ион, называется изоэлектрической точкой (р1). В зависимости от рН среды аминокислота может быть полностью протонирована (катионная форма) или полностью депротонирована (анионная форма):
Аминокислоты вступают в реакции этерификации (по карбоксильной группе), алкилирования и ацилирования (по аминогруппе), могут восстанавливаться, подвергаться декарбоксилированию, образовывать пептиды и т.д. Для идентификации аминокислот используют их способность к образованию внутрикомплексных соединений с различными катионами (серебра, меди, ртути, свинца, цинка, кобальта и др.). Например, с катионом Си2+ образуется внутрикомплексное координационное соединение темно-синего цвета:
Для обнаружения аминокислот применяют и высокочувствительную нингидриновую реакцию, которая позволяет отличить аминокислоты от пептидов и белков. Она протекает при одновременном участии амино- и карбоксильной группы. Хромогенные реакции с солями меди, нингидрином и другими реактивами используют для фотоколориметрического определения аминокислот. Применение аминокислот в медицинской практике основано на их способности участвовать в азотистом обмене, синтезе необходимых для нормальной функции организма белков, пептидов, ферментов, гормонов. В качестве ЛС наиболее часто применяют следующие аминокислоты и их синтетические аналоги: аминалон, кислоту аминокапроновую, кислоту глутаминовую, цистеин, ацетилцистеин, метионин. Природные аминокислоты можно получить гидролизом белков в среде хлороводородной или серной кислоты при нагревании. Источником белков служат мясо, кожа, желатин, шерсть, волосы, перо, казеин творога. Перечисленные химические свойства карбоновых кислот используют в фармацевтическом анализе для идентификации и количественного определения ЛС. Ниже рассмотрим нормативные требования к контролю качества субстанции натрия цитрата, используемой для приготовления инъекционных препаратов, субстанции кальция глюконата, а также производных карбоновых кислот - аскорбиновой кислоты (лактон гидроксикарбоновой кислоты) и аминокислот - глутаминовой и аминокапроновой. Натрия цитрат для инъекций Строение и свойства Натрия цитрат - это натриевая соль лимонной кислоты, относящейся к классу поликарбоновых (трикарбоновых) гидроксикислот:
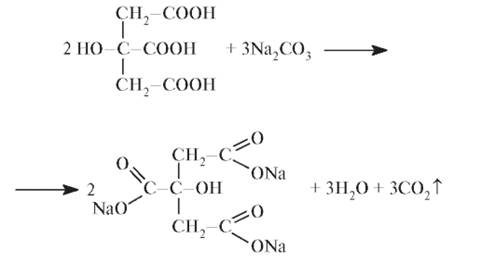
Получение Натрия цитрат получают нейтрализацией раствора лимонной кислоты:
Для очистки от примесей соль перекристаллизовывают из спирта. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 656. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |