Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
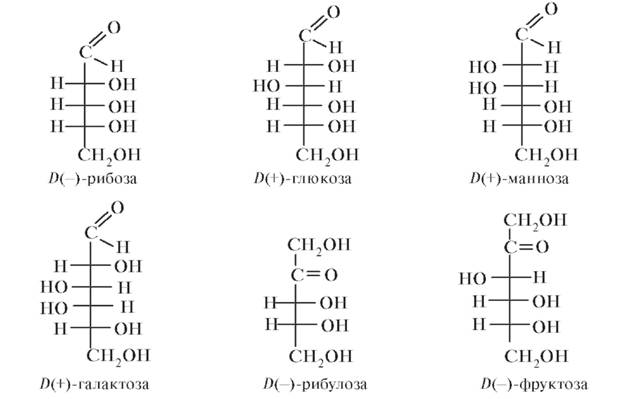
Механизмы действия и биотрансформацияАминокапроновая кислота угнетает фибринолиз, оказывает системный гемостатический эффект при кровотечениях. При энтеральном введении быстро всасывается. Выводится почками в основном в неизмененном виде. Контроль качества Определение подлинности Для идентификации аминокапроновой кислоты снимают ИК-спектр и сравнивают его со спектром стандартного образца. При хроматографировании в тонком слое сорбента с последующей визуализацией нингидриновой реакцией обнаруживают соответствующие пятна для испытуемого раствора и раствора сравнения. Главное пятно по положению, цвету и размеру должно соответствовать пятну, полученному для раствора сравнения. Испытания на чистоту Испытуемый раствор (10,0 г субстанции растворяют в 50,0 мл воды) должен быть бесцветным и оставаться прозрачным в течение 24 ч после приготовления. Значение рН такого раствора - от 7,5 до 8,0. Абсорбция такого раствора при 287 нм - не более 0,10, а при 450 нм не превышает 0,03, что указывает на отсутствие примесей, поглощающих свет в этих областях спектра. Любые пятна, полученные на хроматограмме испытуемого раствора, не должны быть более интенсивными по окраске по сравнению с пятнами на хроматограмме раствора сравнения. Предел содержания тяжелых металлов составляет 10 мкг/г. Потеря в массе при высушивании при 100-105 °С навески в 1,000 г - не более 0,5%. Сульфатная зола не должна быть в концентрации более 0,1% для навески субстанции 1,0 г. Количественное определение. Количественное определение проводят методом неводного титрования. Для этого 0,100 г субстанции растворяют в 20 мл ледяной уксусной кислоты и титруют 0,1 моль/л раствором HClO4 в присутствии индикатора кристаллического фиолетового до изменения окраски из сине-фиолетовой в сине-зеленую.  1 мл 0,1 моль/л HClO4 эквивалентен 13,12 мг C6H13NO2. Контрольные вопросы и задания • Какая функциональная группа присутствует в ЛС класса карбоновых кислот? • Сколько карбоксильных групп содержится в молекуле лимонной кислоты? • Какими химическими свойствами можно объяснить применение натрия цитрата в качестве антацидного средства? • Каков химический механизм применения натрия цитрата в качестве антикоагулянтного средства in vitro? •Приведите основную фармакопейную реакцию определения натрия цитрата. • При количественном определении натрия цитрата 1 мл 0,1 моль/л HClO4 должен соответствовать 8,602 мг C6H5Na3O7. Поясните приведенные цифровые значения, записав соответствующие уравнения реакций. • Сколько гидроксильных и карбоксильных групп содержится в глюконовой кислоте? • Какими методами можно определить подлинность кальция глюконата? Приведите соответствующие реакции. • Опишите сущность индикаторного метода определения примеси кислот в кальция глюконате. • Поясните заключительную фразу в фармакопейной методике количественного определения кальция глюконата: 1 мл 0,05 моль/л раствора трилона Б эквивалентен 22,42 мг C12H22CaO14 ∙ H2O. • Дайте определение лактонов как производных гидроксикарбоновых кислот? В качестве примера рассмотрите аскорбиновую кислоту (витамин С). • Докажите, что по химическому строению кислота аскорбиновая - это у-лактон 2,3-дегидро-Х-гулоновой кислоты. • Как взаимодействует аскорбиновая кислота с разбавленным раствором щелочи? • Запишите реакцию окисления аскорбиновой кислоты до дегидроаскорбиновой. • Объясните, почему для определения подлинности аскорбиновой кислоты может применяться метод поляриметрии? • Как объяснить, что для определения подлинности аскорбиновой кислоты, в молекуле которой отсутствует альдегидная группа, возможно использование реакции серебряного зеркала? • По какой реакции происходит образование из аскорбиновой кислоты кислоты щавелевой - одной из примесей в препарате. • Запишите реакцию йодометрического титрования аскорбиновой кислоты и поясните фармакопейное требование: «1 мл 0,05 моль/л йода эквивалентен 8,81 мг C6H8O6». • На примере глутаминовой и аминокапроновой кислоты опишите химические свойства аминокислот. • Сколько карбоксильных групп содержится в молекуле глутаминовой кислоты? • Продемонстрируйте, что глутаминовая кислота является оптически активным соединением. • Чему равен фактор эквивалентности для глутаминовой кислоты при ее количественном определении по реакции нейтрализации раствором NaOH? • Что такое изоэлектрическая точка? Какой заряд у молекулы аминокислоты в изоэлектрической точке? • Опишите механизм нингидриновой реакции. • Приведите реакцию между аминокислотой и ионом Cu2+. Какие лигандные атомы аминокислоты участвуют в образовании комплексного соединения? • Какие аминокислоты и их синтетические аналоги применяют в качестве ЛС? Углеводы. Глюкоза К классу углеводов относят органические соединения, содержащие альдегидную или кетонную группу и несколько гидроксильных групп. Их состав выражается общей формулой CmH2nOn. В зависимости от состава, строения и свойств, в частности от поведения при нагревании с разбавленными водными растворами кислот (т.е. в зависимости от отношения к гидролизу), углеводы делят на 2 группы: простые и сложные. Простые углеводы не подвергаются гидролизу. Сложные углеводы при гидролизе распадаются с образованием простых углеводов. Углеводы, дающие при гидролизе 2 молекулы простого углевода, называются дисахаридами. Углеводы, при гидролизе которых образуется большее число молекул, называются полисахаридами. Простые углеводы.Подавляющее большинство простых углеводов имеет состав CnH2nOn. Ввиду того что простые углеводы не гидролизуются, их называют моносахаридами. Все простые углеводы - кристаллические вещества, хорошо растворимы в воде, сладкие на вкус. По химическим свойствам они бифункциональны и могут быть охарактеризованы как полигидроксиальдегиды или полигидроксикетоны. Это значит, что в их молекулах содержится альдегидная или кетонная группа и несколько гидроксильных групп. В зависимости от числа углеродных атомов в молекуле, моносахариды делят на несколько групп, названия которых образуют из греческих числительных с добавлением окончания «оза», характерного для углеводов: пентозы, гексозы. Ряд простых углеводов называются рядом моноз. В зависимости от положения в молекуле карбонильной группы моносахариды существуют в виде изомеров: альдоз и кетоз. В связи с тем что в молекулах моносахаридов присутствуют асимметрические атомы углерода, им свойственна оптическая, или зеркальная, изомерия, т.е. они могут существовать в виде нескольких оптических изомеров. Для каждого из оптических изомеров существует один его оптический антипод - энантиомер, остальные являются диастереомерами. Диастереомеры, отличающиеся друг от друга конфигурацией лишь у одного асимметрического атома углерода, называются эпимерами. Для всех моноз установлены относительные конфигурации, т.е. пространственное расположение заместителей у асимметрических атомов относительно конфигурации глицеринового альдегида. Принадлежность моносахарида к тому или иному генетическому ряду определяется по конфигурации его последнего (считая от карбонильной группы) асимметрического атома углерода. Если она соответствует конфигурации D-глицеринового альдегида, т.е. если гидроксил стоит справа, то моноза относится к D-ряду. Если же гидроксил стоит слева и конфигурация последнего асимметрического атома монозы соответствует L-глицериновому альдегиду, ее относят к X-ряду. Природные сахара относятся в основном к D)-ряду, что, видимо, связано с особенностями их первичного биосинтеза в растениях. Принадлежность моносахарида к D- или X-ряду указывает только на то, что он мог бы быть получен из D-или L-глицеринового альдегида. Направление вращения растворами моносахаридов плоскополяризованного луча света зависит от конфигурации всех асимметрических атомов. Конфигурацию моноз, т.е. принадлежность к тому или иному генетическому ряду, обозначают большими буквами D и X, а направление вращения - знаками (+), вправо, и (-), влево. Из альдоз распространены в природе D-рибоза, D-глюкоза, D-манноза и D-галактоза, а из кетоз наиболее известны D-рибулоза и D-фруктоза:
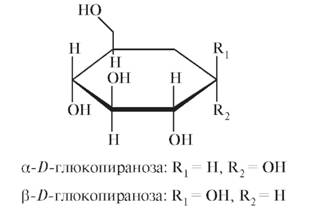
Среди моносахаридов, применяющихся в медицинской практике и включенных в фармакопеи, наибольшее значение имеет глюкоза (см. табл. 10.5). Глюкоза Строение и свойства Субстанция глюкозы - это a-D-глюкопираноза, p-D-глюкопираноза или их смесь:
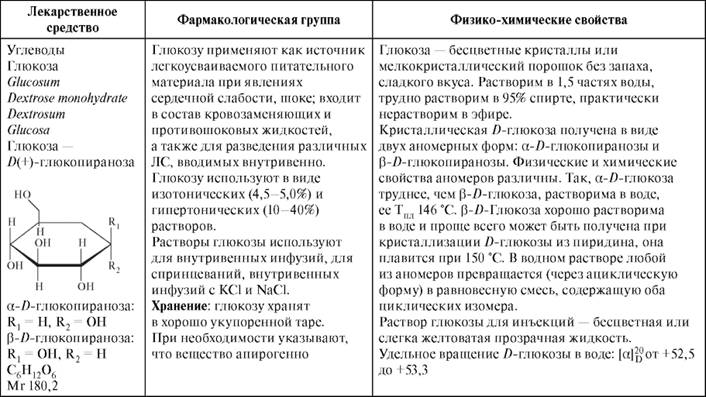
Таблица 10.5. Лекарственное средство глюкоза - представитель класса углеводов
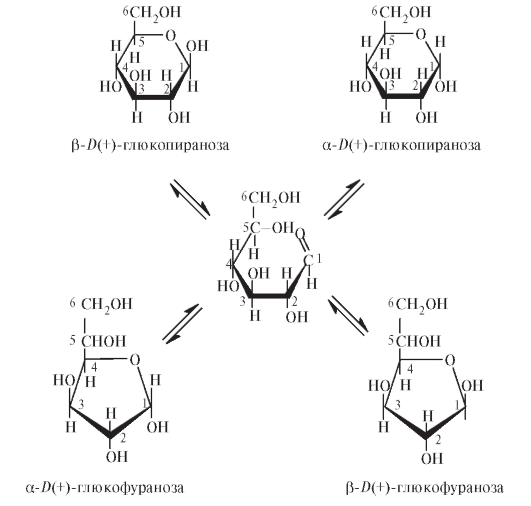
Как и другие моносахариды, глюкоза в водных растворах существует в виде нескольких таутомерных форм (а- и р-пираноз, а- и р-фураноз, открытой альдегидной формы), между которыми в растворах устанавливается равновесие:
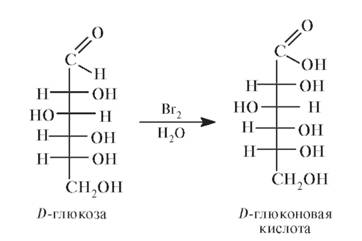
Среди 4 циклических форм D-глюкозы значительно преобладает в растворе p-D-глюкопираноза (64%); содержание же альдегидной формы глюкозы в равновесной смеси составляет всего 0,024%. Концентрация а- и р-глюкофураноз в смеси также ничтожна, и все остальное количество глюкозы представлено а-аномером. В целом пиранозные формы резко преобладают над фуранозными формами. Мягкие окисляющие агенты окисляют функциональные группы более избирательно. Так, под действием бромной воды D-глюкоза окисляется до D-глюконовой кислоты:
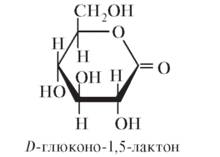
На самом деле при окислении образуется не сама глюконовая кислота, а соответствующий ей лактон.
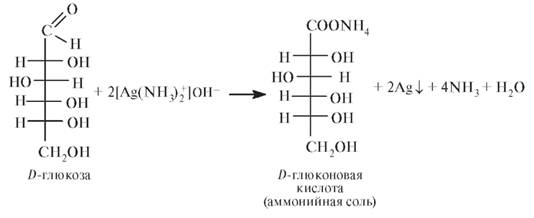
Реактивы Фелинга (фелингова жидкость) и Толленса окисляют альдозы до глюконовых кислот. Каждый из этих реактивов содержит катион металла, который восстанавливается альдозами (отсюда и название этих сахаров - восстанавливающие сахара). Например, при добавлении реактива Толленса осаждается металлическое серебро в виде зеркального покрытия на стенках пробирки:
При использовании реактива Фелинга в присутствии глюкозы происходит восстановление Cu2+ до Cu+ и осаждение Cu2O (см. соответствующую реакцию в теме «Альдегиды»). Реакцию глюкозы с реактивом Фелинга используют для определения подлинности. Для этого к раствору 0,2 г препарата в 5 мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения. Выпадает красный осадок Cu2O. Получение Глюкоза может быть получена гидролизом природных веществ. В промышленности ее получают гидролизом картофельного и кукурузного крахмала. Растворы глюкозы для инъекций соответствующих концентраций готовят следующим образом: к 50, 100, 250 или 400 г глюкозы безводной добавляют раствор хлороводородной кислоты 0,1 моль/л до рН 3,0-4,0; 0,26 г натрия хлорида и воды для инъекций до 1 л. Раствор фильтруют, разливают в ампулы нейтрального стекла по 10, 20, 25 или 50 мл и стерилизуют текучим паром при 100 °С в течение 60 мин или насыщенным паром при 119-121 °С в течение 5-7 мин. Механизмы действия Глюкоза - источник легкоусваиваемого ценного питательного материала при явлениях сердечной слабости, шоке и т.д.; она входит в состав кровезаменяющих и противошоковых жидкостей, а также для разведения различных ЛС, вводимых внутривенно. Глюкозу используют в виде изотонических (4,5-5,0%) и гипертонических (10-40%) растворов.
Контроль качества Определение подлинности Идентификацию глюкозы проводят, определяя удельное вращение 10% раствора, которое должно составлять [α]D20 = +52,5 ÷ +53,3. Определение подлинности можно проводить методом хроматографии в тонком слое. В качестве проявляющего реагента используют раствор 0,5 г тимола в смеси 5 мл серной кислоты и 95 мл этанола. Основное пятно, образующееся на хроматограмме, по положению, цвету и размеру должно быть идентично пятну для раствора сравнения. К раствору 0,1 г глюкозы в 10 мл воды добавляют 3 мл медь-тартратного раствора (реактив Фелинга) и нагревают. Образуется красный осадок Cu2O. Испытание на чистоту Раствор 10,0 г глюкозы в 15 мл воды прозрачный, бесцветный и не имеет запаха. Кислотность и щелочность раствора могут быть оценены потенциометрически или индикаторным методом. Удельное вращение также может быть критерием чистоты субстанции. Посторонние сахара, растворимый крахмал, декстрины определяют, растворив при кипячении 1,0 г субстанции в 30 мл спирта (90 об.%). При охлаждении внешний вид раствора не должен изменяться. Растворимый крахмал и сульфиты определяют, добавляя к испытуемому раствору (1,0 г глюкозы в 10 мл воды) 1 каплю раствора йода. При отсутствии примесей раствор приобретает желтую окраску. В присутствии крахмала образуется синий йодкрахмальный комплекс. Сульфиты окисляются йодом до сульфатов, и желтая окраска исчезает. Содержание сульфитов не должно превышать 15 (SO2) мкг/г, хлоридов - 125, сульфатов - 200, мышьяка - 1, кальция - 200, свинца - 0,5 мкг/г. Содержание воды не должно превышать 1,0% для навески глюкозы 0,5 г. Сульфатная зола - 0,1%. При приготовлении больших объемов раствора глюкозы для парентерального введения должны быть проведены испытания на пирогенность. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 591. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |