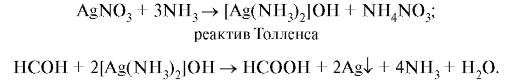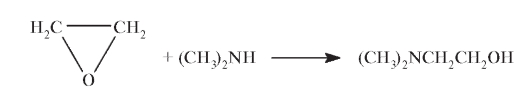Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Раствор формальдегида (формалин)Формалин (см. табл. 10.1) - 34,5-38,0% раствор формальдегида, в который добавляют метанол для стабилизации (предотвращения полимеризации). Формалин используют для удаления бородавок (фармакопея Великобритании). Получение Промышленное производство метаналя основано на парофазном окислении метанола с железомолибденовым катализатором или окислением метана:
В лабораторных условиях формальдегид может быть получен дегидрированием метанола над медью или деполимеризацией параформа. Механизмы действия и биотрансформация Для альдегидов характерны наркотические и дезинфицирующие свойства. По сравнению со спиртами альдегидная группа усиливает токсичность вещества. Контроль качества Определение подлинности Если 1 мл исследуемого раствора (10 мл отфильтрованного раствора формалина с 50 мл воды, не содержащей CO2) разбавить 10 мл воды и к 0,05 мл полученной смеси добавить 1 мл 15 г/л раствора натриевой соли хромотроповой кислоты, 2 мл воды и 8 мл концентрированной серной кислоты, то в течение 5 мин появляется сине-фиолетовое или красно-фиолетовое окрашивание:
Для определения подлинности фармальдегида могут быть использованы реакции с азотсодержащими нуклеофильными соединениями, например с первичными аминами. Образующиеся N-замещенные имины (основания Шиффа) малорастворимы, некоторые из них окрашены, другие дают окрашенные соединения с ионами тяжелых металлов. Например, при добавлении к 0,1 мл исследуемого раствора формалина 10 мл воды и 2 мл 10 г/л свежеприготовленного раствора фенилгидразина гидрохлорида образуется фенилгидразон:
 Фенилгидразон при взаимодействии с раствором калия феррицианида K3[Fe(CN)6] вступает в реакацию замещения лигандов (CN-) во внутренней сфере комплексного иона с образованием продукта красного цвета. При смешивании 0,5 мл исследуемого раствора с 2 мл воды и 2 мл раствора серебра нитрата в слабощелочном растворе аммиака при нагревании на водяной бане образуется серый осадок серебряного зеркала:
Испытания на чистоту Испытуемый раствор должен быть бесцветным. При оценке его кислотности (примесь муравьиной кислоты) применяют индикаторный метод: к 10 мл и 1 мл раствора фенолфталеина добавляют не более 0,4 мл 0,1 моль/л раствора натрия гидроксида, чтобы раствор приобрел красную окраску. Содержание метанола (9,0-15,0%об.) определяют методом газовой хроматографии, используя в качестве внутреннего стандарта этанол. Содержание сульфатной золы, определяемой для навески в 1,0 г, не должно превышать 0,1%. Количественное определение В мерную колбу объемом 100 мл, содержащую 2,5 мл воды и 1 мл раствора натрия гидроксида, добавляют 1,000 г исследуемого раствора, встряхивают и доводят водой до метки. К 10,0 мл раствора добавляют 30,0 мл 0,05 моль/л йода, перемешивают и приливают 10 мл разбавленного раствора натрия гидроксида. Через 15 мин добавляют 25 мл разбавленной серной кислоты и 2 мл раствора крахмала. Титруют 0,1 мл натрия тиосульфата. 1 мл 0,05 моль/л раствора йода эквивалентен 1,501 г CH2O. Метенамин (гексаметилентетрамин, уротропин, тетраазаадамантан) (см. табл. 10.1) можно рассматривать как пролекарство, поскольку физиологическое действие оказывает формальдегид, выделяющийся при разложении метенамина в кислой среде. Получение Метенамин получают конденсацией метаналя и аммиака из водных растворов. Промежуточный продукт реакции - гексагидро-1,3,5-триазин превращается в уротропин:
Контроль качества Определение подлинности 2 мл раствора препарата (1:10) нагревают с 2 мл разведенной серной кислоты; появляется запах формальдегида. Затем прибавляют 2 мл 30 % раствора едкого натра и снова нагревают; появляется запах аммиака. C6H12N4 + 6H2O → 6HCOH↑ + 4NH3↑ Испытания на чистоту В препарате не допускается присутствие примесей органических соодинений, параформа, солей аммония. В определенных пределах допустимы примеси хлоридов, сульфатов, тяжелых металлов. Количественное определение Для количественного определения метенамина используют метод нейтрализации. Для этого навеску препарата нагревают с избытком 0,1 моль/л раствора серной кислоты. Избыток кислоты оттитровывают раствором щелочи с концентрацией 0,1 моль/л (индикатор - метиловый красный). На способности гексаметилентетрамина давать с йодом тетрайодиды основан йодометрический метод количественного определения вещества. Контрольные вопросы и задания • Какую функциональную группу содержат спирты? • Опишите способы получения этанола. • Что такое йодоформная проба? • Перечислите основные реакции подлинности этанола, приведите уравнения реакций. • Назовите источники примесей в этаноле. Напишите уравнения химических реакций, лежащих в основе испытания этанола на чистоту. • Какие методы количественного определения этанола используют в фармацевтическом анализе? • Какая реакция используется как для определения подлинности, так и для очистки альдегидов? • Какие специфические реакции определения подлинности альдегидов применяют в фармацевтическом анализе? • Каковы механизмы взаимодействия формальдегида с хромотроповой кислотой? • Опишите механизм определения подлинности формальдегида реакцией с фенилгидразином. • Каков механизм образования параформа? • Какова массовая доля формалина в формальдегиде? • Каковы механизмы биотрансформации альдегидов? • Приведите механизм реакции серебряного зеркала с реактивом Толленса. • Как определить примесь муравьиной кислоты в формальдегиде? • Какой хроматографический метод используется для определения примеси метанола в формальдегиде? • При количественном определении формальдегида 1 мл 0,05 моль/л раствора йода эквивалентен 1,501 г CH2O. • Приведите фармакопейные способы количественного определения метенамина. Простые эфиры Эфиры представляют собой кислородсодержащие органические соединения общей формулы R1-O-R2(см. табл. 10.3). В зависимости от характера радикала R1 различают 3 типа эфиров: - простые эфиры, R1 - углеводородный радикал; - сложные эфиры неорганических кислот, R1 - остаток неорганической кислородсодержащей кислоты: например, азотной (-NO2), азотистой (-NO), серной (-SO3H); - сложные эфиры карбоновых кислот, R1 - остаток карбоновой кислоты: например, ацил СН3СО- , С2Н5СО- . Среди ЛС часто встречаются соединения, в молекуле которых наряду с другими функциональными группами имеется эфирная группа, - например, некоторые местноанестезирующие средства (новокаин, анестезин):
К эфирам относятся также индоловые алкалоиды, многие кортикостероидные препараты, некоторые гормоны и витамины. Таблица 10.3. Лекарственные средства - производые эфиров
Сложные эфиры широко распространены и в природе. Приятные ароматы цветов, плодов, ягод в значительной степени обусловлены присутствием в них сложных эфиров. Многочисленные жиры, масла по своему химическому строению также представляют собой сложные эфиры. В медицинской практике из соединений, имеющих в качестве функциональной только эфирную группу, применяют эфир этиловый, димедрол, нитроглицерин:
Низшие алифатические эфиры - легколетучие соединения, обладающие характерным запахом. Температура кипения и плотность их ниже, чем у спиртов с тем же числом углеродных атомов. Простые эфиры не смешиваются с водой и малорастворимы в ней. Они легко растворяются в органических растворителях и сами растворяют многие органические вещества. Простые эфиры - нейтральные и малореакционноспособные вещества. Они не реагируют с металлическим натрием, не гидролизуются ни водными растворами щелочей, ни разбавленными кислотами, и только йодоводородная кислота реагирует с простыми эфирами:
Простые эфиры легко окисляются даже кислородом воздуха с образованием взрывоопасных пероксидов и водородпероксидов, что ограничивает область их применения. Это следует учитывать также при получении, хранении, испытаниях. Например, в этиловом (диэтиловом) эфире при самопроизвольном окислении кислородом воздуха могут происходить следующие процессы:
Образование пероксидов этилидена является главной причиной взрыва, поэтому, прежде чем перегонять эфир, необходимо выполнить пробу на пероксиды. О присутствии пероксидов судят по выделяющемуся йоду из раствора йодида калия при взбалтывании его с пробой эфира: r-o-oh + 2ki + h2o → r-oh + i2 + 2koh При обнаружении пероксидов их удаляют восстановителями: FeSO4, SnCl2. Эффективного удаления пероксидов можно достичь, пропуская эфир через хроматографическую колонку, заполненную оксидом алюминия Al2O3. В медицинской практике используют эфир медицинский(Aether medicinalis) и эфир для наркоза(Aether pro narcosi), которые отличаются степенью очистки. В промышленности этиловый эфир получают дегидратацией этилового спирта:
В процессе производства и хранения эфира происходит образование различных побочных продуктов, например: кислот (уксусная, сернистая и серная), непредельных соединений (этилен), уксусного альдегида и различных пероксидов. Кроме того, эфир может содержать примеси воды и этилового спирта. Для очистки от кислот и других примесей эфир промывают водой, высушивают безводным хлоридом кальция и подвергают фракционной перегонке над кристаллическим гидроксидом натрия, удаляя остатки воды и спирта. Как уже отмечалось, чрезвычайно опасной примесью являются пероксиды, которые могут служить причиной несчастных случаев. Особую осторожность следует соблюдать при перегонке долго хранившегося эфира. Для очистки от пероксидов перед перегонкой к эфиру добавляют сульфат железа(П), который восстанавливает пероксиды, окисляясь до железа(Ш). Дополнительную очистку эфира для наркоза проводят с помощью гидросульфита натрия NaHSO3 и щелочного раствора перманганата калия KMnO4, которые взаимодействуют с примесями альдегидов и непредельных соединений. Затем эфир вновь промывают, сушат и перегоняют. Подлинностьпрепарата устанавливают по его физическим константам. Физические свойства фармакопейных препаратов диэтилового эфира сходны. Они лишь незначительно различаются по температуре кипения и плотности (см. табл. 10.3). Следует строго соблюдать правила работы с серным эфиром. При проведении анализа вблизи не должно быть источников огня. Эфир должен быть предварительно проверен на содержание пероксидов по реакции с раствором йодида калия. При визуальном наблюдении не должна появляться желтая окраска ни эфирного, ни водного слоя. При испытаниях на чистотуопределяют кислотность, плотность, температуру перегонки (дистилляции). В препаратах эфира должны отсутствовать альдегиды и вещества с посторонним запахом. Нелетучие примеси определяют по массе остатка, полученного после выпаривания и высушивания (при 100-105 °С) 50 мл препарата. Остаток не должен превышать 0,001 г. Не допускается образование осадка; окраска раствора может быть от желто-бурой до серовато-бурой. В случае эфира для наркоза недопустимо изменение окраски, помутнение, допускается лишь слабая опалесценция. В фармакопейном препарате «Эфир для наркоза» проводят определение содержания воды. С этой целью 20 мл препарата взбалтывают с 0,005 г пикриновой кислоты (2,4,6-тринитрофенол) в сухой пробирке с притертой пробкой. Окраска полученного раствора не должна быть интенсивнее окраски эталонного раствора. Если в препарате присутствует вода, то пикриновая кислота, растворяясь в ней, дает желтую окраску водного слоя. Димедрол Строение и свойства Димедрол (дифенидгидрамин гидрохлорид) относится к классу простых арилалифатических эфиров:
Его можно рассматривать как продукт этерификации ароматического спирта бензгидрола и алифатического спирта диметиламиноэтанола. Получение Получение димедрола осуществляют нуклеофильным замещением брома в дифенилбромметане диметиламиноэтанолом, который синтезируют из этиленоксида и диметиламина:
При нагревании раствора дифенилбромметана и диметиламиноэтанола в толуоле в щелочной среде образуется простой эфир:
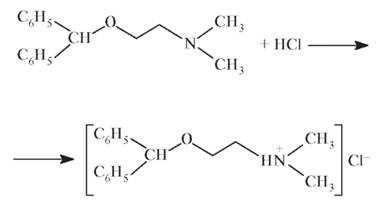
Образующееся основание переводят в соль, действуя хлороводородной кислотой:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 2018. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |