
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРОИЗВОДНЫЕ АЦИКЛИЧЕСКИХ И КАРБОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙСпирты Спирты– это производные углеводородов, молекулы которых содержат гидроксильные группы (табл. 10.1) Табл. 10.1Лекарственное средство этанол - представитель класса спиртов
В зависимости от числа гидроксильных групп спирты бывают одно-или многоатомные:
В зависимости от того, при каком атоме углерода (первичном, вторичном или третичном) находятся гидроксильные группы, различают первичные, вторичныеи третичные спирты:
Введение гидроксильной группы в молекулу углеводорода повышает его растворимость в воде. Действительно, спирты, особенно низшие, хорошо растворяются в воде. С увеличением длины углеродной цепи растворимость спиртов уменьшается. Как правило, вторичные спирты более растворимы, чем первичные, а третичные - более растворимы, чем вторичные. Закономерно изменяется и температура кипения спиртов: она возрастает от первичных спиртов к третичным. Спирты, содержащие менее 12 атомов углерода, представляют собой жидкости. Температура кипения многоатомных спиртов выше за счет увеличения числа межмолекулярных водородных связей.  Химические свойства спиртов определяются их функциональной группой - гидроксильной группой -ОН. Спирты являются слабыми ОН-кислотами, поэтому щелочные металлы вытесняют из спиртов водород:
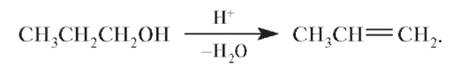
Образующиеся алкоголяты легко гидролизуются: R-ONa + H2O → ROH + NaOH С увеличением числа ОН-групп кислотные свойства спиртов возрастают, что связано с высокой электроотрицательностью кислорода и ослаблением О-Н-связи соседнего гидроксила. Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
В более мягких условиях (температура 170 °С, каталитические
При взаимодействии спиртов с карбоновыми кислотами (в присутствии следов сильных минеральных кислот) образуются сложные эфиры.
Реакция образования сложных эфиров называется этерификацией.Вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ - кислоты и спирта. Первичные и вторичные спирты легко окисляются, причем при окислении первичных спиртов образуются альдегиды, которые окисляются в карбоновые кислоты:
Вторичные спирты окисляются до кетонов:
Для окисления применяют соединения марганца(IV), марганца(VII), хрома(VI). Третичные спирты окисляются с большим трудом. Низшие спирты не поглощают в УФ-области спектра и используются в спектрофотометрии как растворители. Спиртами алхимики называли летучие вещества (от лат. spiritus - дух), выделяющиеся при получении вина. Получение Синтетический этиловый спирт получают гидратацией этилена в присутствии фосфорной (или серной) кислоты:
Значительное количество этилового спирта, так называемый гидролизный спирт, получают из отходов лесной промышленности. При получении спирта брожением пищевого сырья, содержащего крахмал зерновых культур, картофеля, к нему добавляют солод - измельченные проросшие зерна ячменя. Содержащийся в солоде фермент амилазакатализирует превращение крахмала в мальтозу:
Затем под влиянием фермента мальтазыдрожжей дисахарид мальтоза превращается в глюкозу:
Глюкоза под влиянием зимазыдрожжей дает конечные продукты брожения - спирт и углекислый газ:
Для брожения наиболее благоприятна температура 25-30 °С. Образующийся спирт содержит сивушные масла- побочные продукты, образующиеся в процессе брожения: уксусный альдегид, смесь высших спиртов и карбоновых кислот и некоторых других веществ. Спирт, предназначенный для медицинских целей, очищают от токсичных сивушных масел фильтрованием через активированный уголь. После этого спирт подвергают дробной перегонке (ректификации). Промышленный спирт-ректификат содержит 95-96% этанола. Удалить дробной перегонкой оставшиеся 4-5% воды из спирта не удается, так как этиловый спирт, имеющий температуру кипения Ткип 78,3 °С, образует с водой азеотропную смесь, кипящую при температуре 78,15 °С. Чтобы получить абсолютный спирт,азеотропную смесь освобождают от воды химическим способом. Впервые абсолютный спирт был получен нагреванием спирта со свежепрокаленной негашеной известью СаО: 2СаО + 2Н2О → Са(ОН)2. Абсолютировать спирт можно с помощью безводного хлорида кальция или сульфата меди. Для этого в склянку с притертой пробкой помещают прокаленную, т.е. обезвоженную, соль, например сульфат меди, затем приливают 95% спирт (из расчета 1 л спирта на 500 г прокаленной соли) и оставляют смесь на 2 сут, время от времени перемешивая ее. Постепенно кристаллы сульфата меди приобретают синюю окраску, что связано с образованием кристаллогидрата:
Затем спирт отгоняют в приемник, снабженный трубкой с натронной известью (смесь едкого натра NaOH и гашеной извести Ca(OH)2, поглощающая воду и CO2 воздуха). В настоящее время применяют метод абсолютирования спирта с помощью этилата алюминия, который поглощает воду с образованием гидроксида алюминия:
Можно также освободить спирт от воды, добавляя к водному спирту бензол и подвергая смесь перегонке. В этом случае сначала отгоняется постоянно кипящая тройная азеотропная смесь «бензол-вода-спирт» (Ткип 64,85 °С), затем бинарная азеотропная смесь «спирт-бензол» (Ткип 67,8 °С) и, наконец, чистый безводный спирт (78,3 °С). Концентрация спирта выражается в массовых или объемных долях в процентах (1 объемный % = 1°). В фармацевтической практике концентрацию спирта выражают обычно в объемных процентах (градусах). Имеются следующие продажные сорта спирта: 1) спирт-сырец 93-95% крепости; этот спирт недостаточно очищен от сивушных масел и альдегидов; 2) ректифицированный спирт 95-96%, очищенный и почти без примесей; 3) абсолютный спирт 100%, безводный; 4) денатурированный спирт-сырец, к которому добавлены пиридиновые основания, метиловый спирт или сивушные масла. Последний очень ядовит и имеет неприятный запах. Чтобы отличить денатурированный спирт от винного, его подкрашивают. Применяется денатурированный спирт только для хозяйственных целей, например для работы спиртовки. ГФ описывает следующие препараты спирта: безводный, т.е. абсолютный, спирт, и спирт этиловый 95, 90, 70 и 40%. ЕФ содержит 2 статьи: «Этанол (96%)» и «Этанол безводный». Механизмы действия и биотрансформация. Введение гидроксильной группы в молекулу углеводорода значительно повышает его физиологическую активность (в данном случае наркотические свойства вещества), но увеличение числа гидроксильных групп ведет к уменьшению активности. Например, в отличие от этилового спирта, этиленгликоль и глицерин практически не обладают наркотическим действием. Кроме того, на физиологическую активность спиртов оказывают влияние следующие факторы: - длина углеродной цепи - физиологическое действие и токсичность нормальных первичных спиртов возрастают с удлинением углеродной цепи до 6-8 атомов, а затем уменьшаются; - разветвление углеродной цепи - физиологическая активность спиртов усиливается с разветвлением углеродной цепи (например, изобутиловый спирт более активен, чем нормальный бутиловый); - положение гидроксильной группы в молекуле - вторичные спирты оказывают более сильное наркотическое действие, чем первичные спирты, а третичные, в свою очередь, более активны, чем вторичные (так, изопропиловый спирт почти в 2 раза активнее нормального пропилового); - наличие непредельной связи в молекуле - спирты, имеющие в молекуле непредельные связи, обладают более сильными наркотическими свойствами; при этом повышается токсичность спирта; - введение галогенов в молекулу спирта - физиологическое действие спиртов, имеющих в молекуле атомы галогенов, усиливается (к примеру, трибромэтанол CBr3CH2OH обладает гораздо большей активностью, чем этанол). Введение гидроксильной группы в молекулу углеводорода придает соединению сладкий вкус. Это свойство особенно выражено у спиртов с большим числом гидроксильных групп. Например, этиловый спирт С2Н5ОН, как и другие низшие (С1-С3) спирты, обладает характерным алкогольным запахом и жгучим вкусом, а глицерин имеет сладковатый вкус, маннит (шестиатомный спирт) близок по сладости к сахарам. В медицинской и фармацевтической практике наибольшее значение имеет одноатомный спирт этанол. Контроль качества Определение подлинности Подлинность этилового спирта устанавливают йодоформной пробой - при нагревании препарата с йодом в щелочной среде ощущается запах йодоформа: C2H5OH + 4I2 + 6KOH → CHI3↓ +5KI + HCOOK + 5H2O. Однако йодоформную пробу могут давать соединения, имеющие этоксильную группу -OC2H5, некоторые кетоны, гидроксикислоты, поэтому ее нельзя считать строго специфичной только для спирта. Более специфичная реакция на спирт - реакция образования сложных эфиров. Так, при взаимодействии спирта с ледяной уксусной кислотой в присутствии концентрированной серной кислоты образуется уксусно-этиловый эфир, обладающий своеобразным запахом:
Спирт можно окислить дихроматом калия в присутствии серной кислоты до уксусного альдегида со специфическим запахом свежих яблок:
Характерной константой для спирта является плотность, которая растет с уменьшением его содержания в смеси с водой (табл. 10.2). Таблица 10.2.Зависимость плотности этанола от его содержания в смеси с водой
ЕФ предлагает следующие тесты на определение подлинности: определение плотности; снятие ИК-спектра и сравнение его со спектром стандартного образца этанола; окрашивание в синий цвет фильтровальной бумаги, смоченной раствором нитропрус- сида натрия и пиперазона гидрата, после окисления этанола перманганатом калия в кислой среде (пары альдегида); йодоформная проба. Испытания на чистоту. Этиловый спирт может быть загрязнен различными примесями, в числе которых могут быть уксусный альдегид и уксусная кислота. Уксусный альдегид можно обнаружить по реакции образования серебряного зеркала. ГФ регламентируют испытания спирта на кислотность и устанавливает допустимый ее предел. Если спирт плохо очищен, в нем могут присутствовать токсичные сивушные масла, которые определяют по неприятному специфическому запаху. Спирт может быть загрязнен различными непредельными восстанавливающими соединениями, которые обесцвечивают перманганат калия (испытание проводят в течение 20 мин). Примесь метилового спирта в спирте этиловом обнаруживают путем окисления раствором перманганата калия в присутствии фосфорной кислоты: 5СН3ОН + ЗН3Р04 + 2КМп04 — 5НСОН + 2МпНР04 + К2НР04 + 8Н20 Образовавшийся формальдегид открывают с помощью хромотроповой кислоты в присутствии концентрированной H2S04 (см. реакции определения подлинности альдегидов). Отрицательная реакция на формальдегид (фиолетовое окрашивание после добавления реактивов не появляется) свидетельствует об отсутствии примеси метилового спирта. Современные фармакопеи включают в текст ФС образцы хроматограмм с пиками, соответствующими 16 возможным летучим примесям в этаноле. Количественное определение. Концентрацию спирта в лекарственных формах можно установить двумя способами. Один из них основан на определении плотности, другой — температуры кипения водно-спиртовых смесей. Могут быть использованы масс-спектрометрия и ИК-спектроскопия для количественного определения этанола.
Альдегиды и их производные Альдегидами называют органические соединения, в которых карбонильная группа
Поскольку водород и углерод имеют близкие значения относительной электроотрицательности, в альдегидах практически отсутствуют межмолекулярные водородные связи, в связи с чем температура кипения альдегидов ниже, чем у соответствующих спиртов или карбоновых кислот. В качестве примера можно сравнить температуру кипения метанола (Ткип 65 °С), муравьиной кислоты (Ткип 101 °С) и формальдегида (Ткип 21 °С). Формальдегид и ацетальдегид хорошо растворимы в воде в результате образования с ней водородных связей. При удлинении углеродной цепи растворимость в воде снижается. Альдегиды растворяются в органических растворителях, например в спиртах и эфирах. Низшие альдегиды имеют резкий запах, у альдегидов с 3-6 углеродными атомами весьма неприятный запах, в то время как высшие альдегиды обладают цветочными запахами и применяются в парфюмерии. В химическом отношении альдегиды весьма реакционноспособные соединения. Наиболее характерны для них реакции нуклеофильного присоединения, что обусловлено присутствием в молекуле электрофильного центра - карбонильного атома углерода. Многие из этих реакций используют при качественном и количественном анализе ЛС из группы альдегидов потому, что продукты присоединения альдегидов характеризуются определенной для каждого альдегида температурой плавления. Так, альдегиды при встряхивании с насыщенным раствором гидросульфита натрия легко вступают в реакцию присоединения:
Таблица 10.2.Лекарственные средства - производные альдегидов
Окончание табл. 10.2
Способностью альдегидов образовывать гидросульфитные производные пользуются как для определения подлинности препарата с альдегидной группой в молекуле, так и для очистки альдегидов и выделения их из смесей с другими веществами, не реагирующими с гидросульфитом натрия. Альдегиды легко окисляются. Например, альдегиды восстанавливают медь(II) до меди(I). Для проведения реакции к раствору альдегида добавляют реактив Фелинга (щелочной раствор тартратного комплекса меди) и нагревают. Сначала образуется желтый осадок гидроксида меди(I) - CuOH, а затем - красный оксида меди(I) (Cu2O): 2KNa[Cu(C4H4O6)2] + RCOH + 3NaOH + 2KOH → → 2CuOH↓ + RCOONa + 4KNaC4H4O6 + 2H2O 2CuOH → Cu2O + H2O. Некоторые другие соединения (например, полифенолы) также окисляются соединениями Ag(I) и Cu(II), т.е. реакция не является специфической. К окислительно-восстановительным относится также реакция взаимодействия альдегидов с реактивом Несслера в щелочной среде; при этом выпадает темный осадок восстановленной ртути: K2[HgI4] + RCOH + 3KOH → 4KI + RCOOK + Hg↓ + 2H2O. Следует иметь в виду, что реакция с реактивом Несслера более чувствительна, поэтому ее используют для обнаружения примесей альдегидов в ЛС. Альдегиды также легко присоединяют аммиак. Продукты присоединения обычно малоустойчивы и легко подвергаются дегидратации и полимеризации. Образующиеся в результате полимеризации циклические соединения при нагревании с разбавленными кислотами легко разлагаются, вновь освобождая альдегид:
Формальдегид и уксусный альдегид склонны к полимеризации. Формальдегид полимеризуется, образуя циклические тримеры, тетрамеры или линейные полимеры. Реакция полимеризации протекает в результате нуклеофильной атаки кислорода одной молекулы карбонильного атома углерода другой:
Так, из 40% водного раствора формальдегида (формалина) образуется линейный полимер - параформ (n = 8-12), тример и тетрамер. |
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 891. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |








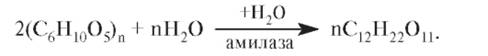





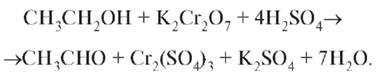
 связана с водородом и с алифатическим или ароматическим углеводородным радикалом (см. табл. 10.2):
связана с водородом и с алифатическим или ароматическим углеводородным радикалом (см. табл. 10.2):




