Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Взаимодействие с кислотами. ⇐ ПредыдущаяСтр 6 из 6 NaOH + HCl = NaCl + H2O (реакция нейтрализации - взаимодействие щелочей с кислотами) 3. Взаимодействие щелочей с кислотными оксидами: 2NaOH + SO3 = Na2SO4 + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O 3. Разложение нерастворимых оснований при нагревании: t Cu(OH)2 = CuO + H2O Соли и их химические свойства. Соли - это сложные вещества, состоящие из ионов металлов и кислотного остатка.
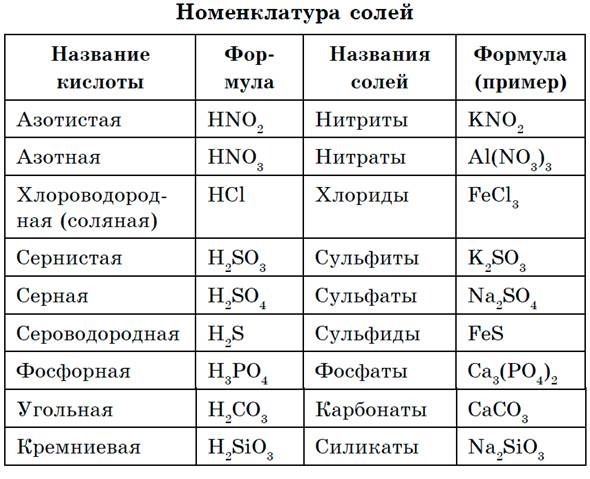
Классификация.
Химические свойства. 1. Взаимодействие с кислотами → выпадает осадок или выделяется газ. BaCl2 + H2SO4 ® BaSO4¯ + 2HCl Na2CO3 + 2HCl ® 2NaCl + CO2+ H2O 2. Взаимодействие с щелочами → выпадает осадок. CuCl2 + 2NaOH ® 2NaCl + Cu(OH)2¯ Fe(NO3)2 + 2KOH ® 2KNO3 + Fe(OH)2¯ Взаимодействие с солями - выпадает осадок. NaCl + AgNO3 ® NaNO3 + AgCl ¯
Оксиды и их химические свойства. Оксиды- сложныесоединения, состоящие из двух химических элементов, один из которых - кислород в степени окисления -2. ЭхОу общая формула оксидов Названия оксидов. А) По международной номенклатуре: Название оксида = «Оксид»+название элемента в родительном падеже + степень окисления
SO2 - оксид серы (IV)
Б) Тривиальные названия: NO – окись азота, N2O – закись азота.
Классификация оксидов. 1) По агрегатному состоянию: Ø Твердые (Pb3O4, SiO2, Cr2O3) Ø Жидкие (Н2О) Ø Газообразные (CO2, CO) 2) По составу: Ø Основные - оксиды металлов, если у Ме валентность I или II (К2O, FeO, CrO, Mn2O) Ø Кислотные - оксиды неметаллов, если у НеМе валентность от IV и более (Сl2O7, P2O5) Ø Амфотерные - Al2O3, ZnO Ø Безразличные - N2O, NO, CO Химические свойства оксидов.  I. Химические свойства основных оксидов. Взаимодействие с кислотами BaO + 2HCl = BaCl2 + H2O Взаимодействие с водой. MgO + H2O = Mg(OH)2 Взаимодействие с кислотными оксидами. CaO + CO2 = CaCO3 II. Химические свойства кислотных оксидов. Взаимодействие с водой. SO3 + H2O = H2SO4 Взаимодействие с основанием. Ca(OH)2 + CO2 = CaCO3 + H2O Взаимодействие с основным оксидом. CO2 + CaO = CaCO3 Реакции ионного обмена в водных растворах. Условия их необратимости. Реакции в растворах электролитов, при которых составные части (ионы) одного вещества обмениваются с составными частями другого и при которых не происходит изменения зарядов ионов, входящих в соединения, называют ионообменными реакциями. С точки зрения теории электролитической диссоциации, в водных растворах протекают реакции не между самими электролитами, а между образованными ими ионами. Возможность протекания ионообменных реакций определяется правилом: Реакции обмена в растворах электролитов протекают практически необратимо и до конца в тех случаях, когда в качестве продукта получаются: 1. осадки (малорастворимые вещества), 2. газы (или легколетучие вещества), 3. слабые электролиты (малодиссоциирующие соединения). В том случае, если образующиеся вещества - сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы, реакция не протекает. Для каждого из случаев приведем примеры: 1. Образование осадков AgNO3 + NaCl = AgCl↓ + NaNO3; Ag+ + NO3– + Na+ + Cl– = AgCl↓ + Na+ + NO3–; Ag+ + Cl– = AgCl↓. 2. Образование газов Na2S + H2SO4 = Na2SO4 + H2S; 2Na+ + S2– + 2H+ + SO42– = 2Na+ + SO42– + H2S↑; 2H+ + S2– = H2S↑. 3. Образование слабых электролитов: а) воды NaOH + HCl = NaCl + H2O Na+ + OH– + H+ + Cl– = Na+ + Cl– + H2O; H+ + OH– = H2O б) слабого основания NH4Cl + KOH = NH4OH + KCl; NH4+ + Cl– + K+ + OH– = NH4OH + K+ + Cl–; NH4+ + OH– = NH4OH в) слабой кислоты 2СH3COONa + H2SO4 = 2CH3COOH + 2Na2SO4 2CH3COO– + 2Na+ +2H+ + SO42– = 2CH3COOH + 2Na+ + SO42– 2CH3COO– + H+ = CH3COOH Если при взаимодействии растворов электролитов не образуется ни одного из указанных видов соединений, то это означает, что химического взаимодействия не происходит: 2NaCl + K2SO4 → Na2SO4 + 2KCl 2Na+ + 2Cl- + 2K+ + SO42- → 2Na+ + SO42-+ 2K++ 2Cl- |
||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 371. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||