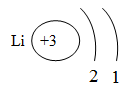Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Физический смысл номера периода.Стр 1 из 6Следующая ⇒ Вопросы с ответами. Периодический закон и периодическая система химических элементов Д.И.Менделеева в свете учения о строении атома. Периодический закон, который формулировал Д.И.Менделеев: Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Периодическая система элементов. Горизонтальный ряд хим. элементов, начинающийся щелочным металлом и заканчивающийся инертным газом, называется периодом. I, II, III - малые периоды, т.к. состоят из одного ряда хим. элементов, имеют малое число элементов. I - 2 элемента
III IV - VII - большие периоды, т.к. состоят из двух рядов (четного и нечетного) элементов. В четных рядах больших периодов располагаются типичные металлы. Нечетный ряд начинается металлом, затем металлические свойства ослабляются и нарастают свойства неметаллические, заканчивается период инертным газом. Группа- это вертикальный ряд хим. элементов, объединенных по хим. свойствам. Группа Главная подгруппа побочная подгруппа В главную подгруппу входят В побочную подгруппу входят элементы и малых, и больших элементы только больших периодов. периодов. H, Li, Na, K, Rb, Cs, Fr Cu, Ag, Au малые большие большие Для элементов, объединенных в одну и ту же группу, характерны следующие закономерности: 1. Высшая валентность элементов в соединениях с кислородом ( за некоторым исключением) соответствует номеру группы.  Элементы побочных подгрупп могут проявлять и другую высшую валентность. Например, Cu - элемент I группы побочной подгруппы - образует оксид Cu2O. Однако, наиболее распространенными являются соединения двухвалентной меди. 2. В главных подгруппах (сверху вниз) с увеличением атомных масс усиливаются металлические свойства элементов и ослабевают неметаллические. Строение атома. Электронные формулы и графические схемы строения электронных слоев атомов. Атомы, представляют собой сложные образования, построенные из более мелких структурных единиц.
n0 - нейтрон ē - электрон - вне ядра Число электронов в атоме равно числу протонов, т.е. порядковому номеру элемента, так как атом электронейтрален. Каждый хим. элемент в периодической системе был пронумерован. Номер, который получает каждый элемент, называется порядковым номером. Физический смысл порядкового номера: 1. Каков порядковый номер элемента, таков и заряд ядра атома. 2. Столько же электронов вращается вокруг ядра . Z = р+ Z - порядковый номер элемента Z = ē n0 = А - Z n0 = А - р+ А - атомная масса элемента n0 = А - ē Например, Li. Z = 3 р+ = 3 ē = 3 n0= 7- 4 = 3 Физический смысл номера периода. В каком периоде находится элемент , столько электронных оболочек (слоев) он будет иметь.
Определение максимального числа электронов на одной электронной оболочке: 2n2 n - номер уровня 2, 8, 18, 32 Типичными Ме являются те элементы, которые на внешней эл. оболочке содержат от 1 до 2 ē. Типичные НеМе на внешней эл. оболочке содержат от 4 до 8 ē. В каждом периоде Ме свойства уменьшаются, а НеМе усиливаются. В пределах одной и той же группы (в главной подгруппе) Ме свойства усиливаются, а НеМе ослабевают. Электронное строение атома. + n
S S P S P d S P d f Каждый энергетический уровень делится на энергетические подуровни: S, P, d, f и т.д.
S 2 ē
d 10 ē
не спаренный спаренные |
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 522. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |