
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Ионная связь, ее образование. Заряды ионов.В Периодической системе Д.И.Менделеева особняком стоят благородные газы. Атомы благородных газов имеют завершенный внешний электронный слой, на котором у атома гелия находится два электрона, а у атомов остальных элементов - по восемь. Атомы всех других химических элементов стремятся приобрести именно такую устойчивую электронную конфигурацию и достигают этого либо в результате присоединения электронов от других атомов, либо в результате отдачи своих электронов с внешнего уровня другим атомом. Если различие в ЭО элементов достаточно велико, то может произойти не просто смещение электронов в сторону более ЭО элемента, а полная передача электронов от одного атома к другому. Например, при возникновении химической связи между атомами Na и Cl валентный электрон натрия переходит на внешний электронный слой хлор, достраивая его до восьмиэлектронной структуры.
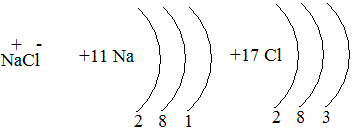
Na0 + Cl0 Na+ + Cl- Na+ Cl- . атом атом ион ион ионное соединение
Ионы- это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов. Атомы, которые почти полностью отдают свои валентные электроны, превращаются в положительно заряженные ионы (катионы), а атомы, которые эти электроны приобретают, - в отрицательно заряженные ионы (анионы).
Cl0 + 1 ē → Cl- Разноименно заряженные ионы, притягиваясь друг к другу силой электростатического притяжения, образуют соединение - NaCl. Химическая связь, возникающая между катионами и анионами в результате действия электростатических сил притяжения, называется ионной связью.  Соединения, которые при этом образуются, называются ионными соединениями. Соединения с ионным типом химической связи образуются в том случае, когда взаимодействуют атомы элементов с резко различной ЭО - типичного Ме (щелочными и щелочноземельными) и типичного НеМе (галогенами, кислородом). Классическим примером веществ с ионной связью являются галогениды и оксиды щелочных металлов. Ионные соединения - это не только бинарные соединения щелочных и щелочноземельных металлов. Это также соединения, образованные тремя и более элементами. Это все соли кислородсодержащих кислот, а также гидроксиды щелочных и щелочноземельных металлов. Классификация ионов по разным признакам: По составу простые сложные Na+, Cl-, Ca2+ OH-, SO42-, NH4+ По знаку заряда катионы анионы Ме+, NH4+, H+ OH-, анионы кислотных остатков
Типы кристаллических решеток. Зависимость свойств веществ от типа кристаллической решетки. Кристаллические решётки веществ -это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки, в которых размещены частицы кристалла, называютсяузлами решетки. Типы кристаллических решеток
Ионные кристаллические решетки В узлах ионных кристаллических решеток –ионы.
Физические свойства веществ с ионной кристаллической решеткой: 1. Большая твердость. 2. Малая летучесть. 3. Хорошая растворимость в воде. 4. Высокая tпл.
|
|||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 402. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
