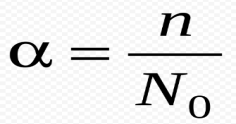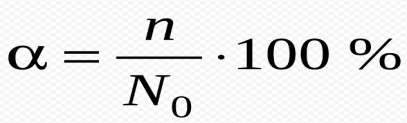Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Электролитическая диссоциация. Механизм растворения в воде веществ с ионной связью. Степень диссоциации. Сильные электролиты.Электролитическая диссоциация- это процесс распада электролита на ионы при растворении его в воде или расплавлении. Электролиты– это вещества, водные растворы или расплавы которых проводят электрический ток. Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток.
Механизм растворения в воде кристалла NaCl:
Степень диссоциации (α)– отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
n –число диссоциированных молекул N –общее число молекул
Кислоты и их химические свойства. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация кислот. 1) По содержанию кислорода:
По количеству кислорода
По растворимости в воде
По стабильности
Химические свойства. Действие их на индикаторы. Индикаторы - вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).  В кислотах:
Диссоциация кислот. 1) HCl ↔ Н+ + Cl-
2) H2SO4 ↔ 2Н+ + SO42- 3) H3PO4 ↔ 3Н+ + PO43-
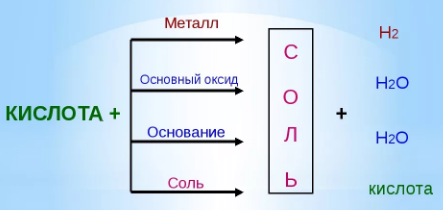
Кислоты взаимодействуют с металлами, оксидами металлов, основаниями и солями. Во всех случаях основным продуктом реакции будет соль.
Взаимодействие кислот с металлами. Если металл находится в ряду активности до водорода, то он реагирует с кислотами, если после, то – нет.
Zn + 2HCl = ZnCl2 + H2↑ (реакция замещения) Fe + 2HCl = FeCl2 + H2↑ (реакция замещения) Cu + HCl ≠ Взаимодействие кислот с оксидами металлов. CuO + H2SO4 = CuSO4 + H2O (реакция обмена)
NaOH + HCl = NaCl + H2O (реакция обмена) Cu(OH)2 + 2HCl = CuCl2 + 2H2O (реакция обмена) Взаимодействие кислот с солями. BaCl2 + H2SO4 = BaSO4↓ + 2HCl (реакция обмена) Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ (реакция обмена) Основания и их химические свойства. Основания- сложные вещества, которые состоят из ионов металла или иона аммония и гидроксогруппы (-ОН). Хорошо растворимые в воде основания называются щелочами. Общая формула оснований Ме(ОН)n где n – число ОН- групп, численно равное значению заряда иона (степени окисления) металла. +1 +2 +3 NaOH, Ca(OH)2, Fe(OH)3.
Названия оснований состоят из слова "гидроксид" и наименования металла в родительном падеже: NaOH - гидроксид натрия Са(ОН)2 - гидроксид кальция.
Если металл проявляет переменную степень окисления, то ее величину указывают римской цифрой в скобках и произносят в конце названия основания:
CuOH - гидроксид меди (I) (читают "гидроксид меди один) Cu(OH)2 - гидроксид меди (II) (читают "гидроксид меди два)
Классификация. По растворимости в воде.
Химические свойства. Действие индикаторов. Индикаторы- вещества, изменяющие цвет в зависимости от среды. В щелочах:
Нерастворимые основания в воде не растворяются и окраску индикаторов не изменяют. Диссоциация оснований.
2) Ba(OH)2 ↔ Ba2+ + 2OH- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 416. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||