
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Методы устранения жесткости воды⇐ ПредыдущаяСтр 12 из 12
Цель работы: умягчить водопроводную воду катионитным или известково-содовым методом, определить жесткость воды до и после умягчения.
Оборудование и реактивы: колонка с катионитом, 0,1н. раствор трилона Б (18,61 г в 1 л раствора), индикатор эриохром черный кристаллический, мерный цилиндр на 250 мл, 6 – 8%-ный раствор хлорида натрия, аммиачный буферный раствор, бюретки; пипетки на 100 мл или мерные цилиндры; конические колбы на 250 мл и 500 мл, коническая колба на 2 литра, сода, известь, весы, воронка для фильтрования со складчатым бумажным фильтром, стаканы на 200 – 250 мл, мерные колбы на 200 мл.
15.1 Теоретические пояснения
Жесткость воды чаще всего устраняется при помощи ионитов и известково-содовым методом. Другие методы находят более ограниченное применение в виду их нерентабельности (высокая стоимость и трудоемкость). Умягчение воды может быть достигнуто: 1) осаждением катионов кальция и магния с последующим удалением осадка; 2) удалением катионов кальция и магния методом ионного обмена. Метод ионного обмена основан на способности ионитов поглощать из растворов одни ионы и отдавать в раствор в эквивалентных количествах другие. Иониты, способные обмениваться с раствором катионами, называются катионитами. К катионитам относятся: алюмосиликаты, сульфированные угли, синтетические смолы. Характерной особенностью катионитов является наличие в них большого числа кислотных групп: силикатных, карбоксильных, сульфогрупп. Эти группы содержат подвижные катионы водорода, способные замещаться другими катионами, например, R-SO2OH + Me+ D R-SO2OMe + H+ Иониты, способные обмениваться с раствором анионами, называются анионитами. Аниониты представляют собой аминосмолы, содержащие амино- и имино-группы.  R-NH2 + HOH D [R-NH3]+OH- [R-NH3]+OH- + А- D [R-NH3]+ A- + OH- Для умягчения воды применяются обычно катиониты в водородной и натриевой форме (Н-катиониты и Na-катиониты). Если обозначить весь катионит, кроме подвижного иона, например, натрия, буквой R, то реакции ионного обмена в жесткой воде могут быть выражены следующими уравнениями: Na2R + (Са,Mg) (НСО3)2 D (Са, Mg)R + 2NаНСО3 Na2R + (Са,Mg) SO4 D (Са, Mg)R + Na2SO4 Na2R + (Са, Mg)Cl2 D (Са, Mg)R + 2NaCl Количество катионов кальция и магния, которое может быть поглощено определенным количеством катионита, называется емкостью поглощения и выражается в моль эквивалента на 1 м3 ионита. Например, емкость поглощения сульфоугля равна 1000 моль экв./м3; апатита – 1700 моль экв./м3; После длительной работы иониты насыщаются и теряют свои эксплуатационные качества. С целью возобновления работы иониты подвергают регенерации. Для замены катионов жесткости на катионы натрия, через ионит пропускают насыщенный раствор хлорида натрия. При этом катионы кальция и магния вытесняются катионами натрия. В известково-содовом методе умягчения воды используют смесь соды и гашеной извести. Соли, дающие карбонатную жесткость, и растворенный в воде оксид углерода (IV) под действием извести переводятся в осадок: Са(НСО3)2 + Са(ОН)2 → 2СаСО3$ + 2Н2О Mg(НСО3)2 + Са(ОН)2 → MgCO3$ + СаСО3$ + 2Н2О Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2$ + 2CaCO3$ + 2H2O. СО2 + Са(ОН)2 → СаСО3$ + Н2О Одновременно магниевая жесткость заменяется на кальциевую, так как образовавшийся в качестве продукта ионного обмена гидроксид магния в воде растворим хуже, чем гидроксид кальция: MgCl2 + Са(ОН)2 → Mg(OH)2 + CaСl2 Содой удаляют соли, обусловливающие некарбонатную жесткость воды: CaSO4 + Nа2СО3 → СаСО3$ + Na2SO4 CaCI2 + Na2CO3 → СаСО3$ + 2NaCl Карбонаты выпадают в виде взвеси. После фильтрования вода содержит соли, не дающие накипи, поэтому вполне пригодна для многих промышленных целей. В последние годы все большее значение приобретает метод удаления солей с помощью постоянного электрического тока, называемый электродиализом. Этот метод оказался более экономичным по сравнению с ионообменным. Принципиальная схема этого метода представлена на рисунке 15.1. Если через воду, находящуюся в ванне, разделенной полупроницаемыми диафрагмами на три отделения, пропускать постоянный электрический ток, то при соответствующем напряжении будет происходить электролиз растворенных солей. Катионы из анодного пространства и из средней камеры под действием электрического поля перемещаются в катодное пространство, где в результате электролиза накапливается раствор гидроксидов натрия, калия, магния и выделяется водород. Анионы из катодного пространства и из средней камеры перемещаются в анодное пространство, где накапливаются за счет электролиза соляная и серная кислоты, а также выделяется кислород и частично хлор.
Рисунок 15.1 – Схема обессоливания воды электродиализом: 1,2 - катодное и анодное пространства; 3- межэлектродное пространство (обессоливаемая вода); 4, 5- катодная и анодная мембраны; 6,7- катод и анод.
По мере прохождения электролиза в средней камере количество катионов и анионов уменьшается, вода обессоливается. Загрязненную солями воду из катодного и анодного пространства сливают, поскольку она является отходом, а из среднего пространства частично очищенная вода поступает в другой электродиализатор для более глубокого обессоливания. Описанный метод применяется для опреснения воды, например морской, используемой как для бытовых нужд, так и для получения воды особой чистоты, используемой при получении ультрачистых веществ.
15.2 Методика проведения опытов
15.2.1 Опыт №1. Умягчение воды методом ионного обмена В качестве катионитной колонки применяют стеклянную трубку диаметром 2-3 см и длиной 80-90 см. Для того чтобы катионит не высыпался, в нижнюю часть трубки впаивают стеклянную пластинку с отверстиями и конец трубки оттягивают. Можно также использовать и обычную трубку, закрыв ее нижнюю часть пробкой с узкой стеклянной трубкой. Колонку наполняют катионитом так, чтобы высота слоя составляла 50-60 см. Приготовляют 6-8 %-ный раствор хлорида натрия (плотность 1,06–1,085 г/см3) и пропускают 600 – 700 мл его через колонку. Затем избыток соли отмывают дистиллированной водой до практически полного исчезновения реакции на хлорид-ион (проба с нитратом серебра). Обычно на отмывку расходуется около 1000 мл воды. После отмывки катионита через него пропускают 200 мл воды, подлежащей умягчению, например, водопроводной. Затем определяют жесткость профильтрованной (умягченной) воды и сырой водопроводной воды. Для этого в коническую колбу емкостью 250 мл отмеряют 100 мл анализируемой воды и 5 мл буферного раствора. Затем титруют 0,1 н. раствором трилона Б в присутствии индикатора до перехода вишнево-красной окраски раствора в сине-фиолетовую в соответствии с методикой, описанной в лабораторной работе №14. По результатам титрования рассчитайте жесткость воды до и после ее умягчения. Сделайте вывод об эффективности метода.
15.2.2 Умягчение воды известково-содовым методом При умягчении воды известково-содовым методом предварительно определяют карбонатную жесткость воды, ее некарбонатную и магниевую жесткость, а также содержание оксида углерода (IV) (данные о магниевой жесткости и содержании оксида углерода (IV) студенты получают у преподавателя). На основании этих данных рассчитывают количество извести и соды, необходимых для устранения жесткости. Например, найдено, что карбонатная жесткость равна 5 ммоль экв./л, некарбонатная – 3 ммоль экв./л, магниевая жесткость – 2 ммоль экв./л, содержание оксида углерода (IV) – 11 мг/л. Тогда извести для устранения карбонатной жесткости необходимо 5 ммоль экв./л, для устранения магниевой жесткости – 2 ммоль экв./л и на нейтрализацию СО2 потребуется 11∙ Масса извести на 1 литр воды: m(Ca(OH)2)= ν(1/2Ca(OH)2)∙М(1/2Ca(OH)2)=7,5∙37 = 277,5 (мг) = 0,277(г) Для устранение некарбонатной жесткости 1 литра воды потребуется 3 ммоль экв./л соды, что составит в массовом выражении m(Na2CO3) = ν(1/2 Na2CO3)∙М(1/2 Na2CO3) = 3∙53 = 159 (мг) = 0,159 (г). После расчета отвешивают с точностью до 0,01 г известь и соду и растворяют их в 1 л воды, налитой в двухлитровую колбу. Содержимое колбы взбалтывают в течение 2-3 мин, дают отстояться и фильтруют через складчатый фильтр. Первые порции фильтрата отбрасывают. Отфильтровав 200 мл воды, берут пробу для анализа ее жесткости. Анализ проводят в соответствии с методикой, приведенной в лабораторной работе №14. По результатам анализа сделайте вывод об эффективности метода.
15.3 Требования к уровню подготовки студентов
˗ Знать понятия: общая, временная (карбонатная) и постоянная (некарбонатная) жесткость воды. ˗ Понимать для чего необходимо умягчение воды. ˗ Иметь представление о методах устранения временной и постоянной жесткости. ˗ Уметь производить расчеты жесткости воды, а также расчеты количеств реактивов, необходимых для ее устранения.
15.4 Задания для самоконтроля
15.4.1 Для устранения карбонатной жесткости применяют одно из следующих веществ: едкий натр, гашеную известь, ортофосфат натрия. Какое из названных веществ окажется наиболее эффективным, если взять их в одинаковых количествах? Обоснуйте ответ, приведя уравнения реакций и соответствующие расчеты. 15.4.2 Почему для регенерации катионита его промывают раствором хлорида натрия, а затем водой? Можно ли применить для регенерации катионита раствор хлорида кальция? 15.4.3 Вода содержит 0,12 г/л растворенного гидрокарбоната кальция. Сколько нужно прибавить извести к 10 л такой воды, чтобы осадить гидрокарбонат в виде карбоната? 15.4.4 Почему для полного обессоливания воды необходимо применять смесь катионитов и анионитов? Почему нельзя их применять в отдельности? 15.4.5 Какую реакцию среды имеет: а) Na-катионированная вода, 15.4.6 Карбонатная жесткость исходной воды 3,8 ммоль экв/л. Определить концентрацию (мг/л) NaHCO3 после умягчения воды на натрий-катионитовом фильтре. 15.4.7 Вычислить количество 60%-ной извести, необходимое для умягчения 500 м3 воды с исходной карбонатной жесткостью 3,8 ммоль экв/л и содержанием СО2 15,4 мг/л. 15.4.8 Какое количество 70%-ной извести и соды Na2CO3∙10H2O необходимо для умягчения 1 м3 воды. Общая жесткость – 3,8 ммоль экв/л, карбонатная жесткость – 2,4 ммоль экв/л, содердание СО2 – 3,8 ммоль экв/л. 15.4.9 Почему при использовании реагентных методов не достигается полное удаление ионов Са2+ и Mg2+?
15.5 Список рекомендуемой литературы
15.5.1 Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1: Титриметрические и гравиметрический методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. – М.: Дрофа, 2009. – 368 с.
Заключение
Настоящая методическая разработка призвана повысить эффективность использования аудиторного времени при проведении лабораторных занятий, активизировать самостоятельную работу студентов. Предполагается, что методические указания станут руководством к систематической, целенаправленной и вдумчивой работе по применению теоретических знаний к решению конкретных практических задач в рамках химического практикума для направления подготовки бакалавров 280100 Природообустройство и водопользование, профиль подготовки «Природоохранное обустройство территорий». Использованная литература
1 Ахметов Н.С. Общая и неорганическая химия: Учебник для вузов. – М.: Высш. шк., 2009. – 743 с. 2 Ахметов Н.С. Лабораторные и семинарские занятия по общей и неорганической химии/ Н.С.Ахметов, М.К.Азизова, Л.И.Бадыгина. – М.: Высш. шк.; Изд. центр «Академия», 1999. – 368 с. 3 Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1: Титриметрические и гравиметрический методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. – М.: Дрофа, 2009. – 368 с. 4 Васильев В.П. Аналитическая химия. В 2 кн. Кн. 2:Физико-химические методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. – М.: Дрофа, 2009. – 384 с. 5 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с. 6 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 7 Гольбрайх З.Е. Сборник задач и упражнений по химии: Учебное пособие для студентов/ З.Е. Гольбрайх, Е.И.Маслов. – М.: ООО «Издательство АСТ»: ООО «Издательство Астрель», 2004. – 383 с. 8 Гузей Л.С. Общая химия: Учебник/ Л.С.Гузей, В.Н.Кузнецов, А.С.Гузей. – М.:Изд – во МГУ, 1999. – 333 с. 9 Задачи и упражнения по общей химии: Учебное пособие для вузов/ Б.И.Адамсон, О.Н.Гончарук, В.Н. Камышова и др.; под ред. Н.В.Коровина. – М.: Высш. шк., 2003. – 255 с. 10 Кораблева Т.П. Теория периодической системы: Учебное пособие/ Т.П.Кораблева, Д.В.Корольков. – СПб.: Издательство С.-Петербургского университета, 2005. – 174 с. 11 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с. 12 Коровин Н.В. Лабораторные работы по химии: Учеб. пособие для техн. направлений и спец. вузов/ Н.В.Коровин, Э.И. Мингулина, Н.Г.Рыжова. Под ред. Н.В.Коровина. – М.: Высш. шк., 2007. – 256 с. 13 Корольков Д.В. Основы теоретической химии: Учеб. пособие для студ. высш. учеб. заведений/ Д.В. Корольков, Г.А. Скоробогатов. – М.: Издательский центр “Академия”, 2004. – 352 с. 14 Практикум по общей и неорганической химии: Учеб. пособие/ Л.С.Гузей, В.Н.Кузнецов, Г.П.Жмурко и др. – М.: Изд-во МГУ, 2000. – 88 с. 15 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – 17 Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов, обуч. по направ. и спец. «Химия». – М.: Высш. шк., 1997. – 527 с. [*] Мениск – вогнутая (если жидкость смачивает поверхность стекла) или выпуклая (если жидкость не смачивает поверхность стекла) утолщенная поверхность жидкости в узких трубках. |
||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 232. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

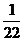 = 0,5 ммоль экв./л извести (
= 0,5 ммоль экв./л извести (