
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Основные классы неорганических соединений (часть II: кислоты, соли)
Цель работы: усвоение классификации и взаимосвязи между основными классами неорганических соединений; получение неорганических соединений и изучение их свойств.
Оборудование и реактивы: спиртовка, штатив с бюреткой, держатель для пробирок, пинцет, шпатели, фильтровальная бумага, пробирки, колбочка на 50 мл, пипетки, стеклянная трубочка, фарфоровая чашка, индикаторы: фенолфталеин и метиловый оранжевый, дистиллированная вода, кристаллический ацетат натрия, металлический цинк, 0,5н. растворы CuSO4,, CoCl2, FeCl3, Na2SO4, NaCl, Pb(NO3)2 или Pb(CH3COO)2, 2н. растворы NaOH, H2SO4, HCl, 30% раствор NaOH, 10% раствор NH4OH, известковая вода.
4.1 Теоретические пояснения
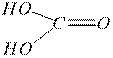
Кислотные гидроксиды – это кислородсодержащие кислоты, в состав которых входят гидроксильные группы: H2SO4 HNO3 H2CO3
Кислотные гидроксиды диссоциируют в воде с образованием в качестве катионов только ионов водорода Н+, взаимодействуют с основаниями и основными оксидами с образованием солей. Следует отметить, что понятие кислоты шире, чем понятие кислотного гидроксида, так как существуют и бескислородные кислоты, например, HCl, HF, H2S, HCN и другие. В номенклатуре кислотных гидроксидов (кислот) используются как тривиальные, так и систематические названия. Последние полностью отражают состав соединения и даются по правилам составления названий комплексных соединений. Систематические названия рекомендуется давать лишь малораспространенным кислотам, образованным элементами с переменной степенью окисления. Например, H6TeO6 – гексаоксотеллурат (VI) водорода. Однако серную кислоту вовсе не требуется называть тетраоксосульфат (VI) водорода, за ней сохраняется традиционное название.  При взаимодействии между собой гидроксидов и оксидов, с различными кислотно-основными свойствами, образуются соли. Соли по составу подразделяются на простые, двойные, смешанные и комплексные. Двойные соли образованы двумя различными катионами и одним анионом. Например, KAl(SO4)2 – сульфат алюминия-калия. Смешанные соли образованы несколькими различными анионами (кислотными остатками) и одним катионом. Например, Ca(ClO)Cl – хлорид-гипохлорит кальция или хлорная известь. Комплексные соли содержат в своем составе сложные комплексные ионы, которые в химических реакциях, процессах растворения, в структуре кристалла ведут себя как самостоятельные единицы. Например, K4[Fe(CN)6] гексацианоферрат (II) калия диссоциирует в воде на ионы в соответствии с уравнением K4[Fe(CN)6] Комплексный анион практически не диссоциирует в водном растворе, поэтому Fe2+ не обнаруживается качественными реакциями. Простые соли по характеру замещения подразделяются на средние (нормальные), кислые и основные. Средние соли, например, CuSO4, Na2CO3 и другие, являются продуктами полного замещения ионов водорода в кислоте на другие катионы или продуктами полного замещения гидроксильных групп в основании на кислотные остатки. Перечислим некоторые основные способы образования средних солей: ˗ взаимодействие металлов с кислотами Zn + 2HCl = ZnCl2 + H2; ˗ взаимодействие металлов, оксиды которых амфотерны, со щелочами Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2; ˗ взаимодействие основания с кислотой NaOH + HCl = NaCl + H2O; ˗ взаимодействие основания с кислотным оксидом Ca(OH)2 + CO2 = CaCO3¯ + H2O; ˗ взаимодействие кислоты с основным оксидом CaO + 2HCl = CaCl2 + H2O; ˗ взаимодействие кислоты с солью (более сильная кислота вытесняет более слабую, летучую, разлагающуюся или выпадающую в осадок кислоту из ее соли) 2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4; ˗ взаимодействие растворимого основания с солью FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl; ˗ взаимодействие между солями NaCl + AgNO3 = AgCl¯ + NaNO3; ˗ взаимодействие солей с металлами CuSO4 + Zn = Cu¯ + ZnSO4; ˗ взаимодействие основных и кислотных оксидов SO3 + CaO = CaSO4; ˗ взаимодействие металлов с неметаллами 2Fe + 3Cl2 = 2FeCl3. Кислые соли можно рассматривать как продукты неполного замещения ионов водорода в двух- или более основной кислоте на другие катионы. Кислые соли получаются при взаимодействии кислоты или кислотного оксида с недостатком основания, либо взаимодействием средней соли с кислотой или кислотным оксидом. H2SO4 + NaOH = NaHSO4 + H2O; CO2 + KOH = KHCO3; Ca3(PO4)2 + H3PO4 = 3CaHPO4; CaCO3 + CO2 + H2O = Ca(HCO3)2. Так как в анионе кислой соли содержится подвижный водород, то она частично сохраняет свойства кислоты и может вступать в реакцию нейтрализации с основаниями. NaHSO4 + NaOH = Na2SO4 + H2O. Основные соли можно рассматривать как продукты неполного замещения ОН – групп в многокислотных основаниях на кислотные остатки. Эти соли получаются при взаимодействии основания с недостатком кислоты или средней соли с основанием. Mg(OH)2 + HCl = MgOHCl + H2O; CoCl2 + NaOH = CoOHCl¯ + NaCl. Так как в состав основных солей входят гидроксильные группы, то эти соли могут взаимодействовать с кислотами с образованием средних солей. Таким образом, основные соли частично сохраняют свойства оснований. MgOHCl + HCl = MgCl2 + H2O Систематические названия солей связаны с систематическими названиями соответствующих кислот. Традиционные названия солей кислородсодержащих кислот составляются из названия аниона в именительном падеже и катиона в родительном падеже. Название аниона включает корень русского или латинского названия кислотообразующего элемента с добавлением суффикса, соответствующего степени окисления элемента. При этом возможны следующие случаи: ˗ если кислотообразующий элемент имеет только одну степень окисления, то добавляется суффикс –ат ( Na2CO3 – карбонат натрия); ˗ если кислотообразующий элемент имеет две степени окисления, то при высшей из них к корню добавляется суффикс –ат, а при низшей степени окисления добавляется суффикс –ит (CaSO4 – сульфат кальция, Na2SO3 – cульфит натрия); ˗ если имеются анионы, отвечающие четырем степеням окисления кислотообразующего элемента, то для высшей степени окисления используется приставка пер- и суффикс -ат (КCl+7O4 – перхлорат калия), затем суффикс –ат (KCl+5O3 – хлорат калия), суффикс –ит (KCl+3O2 – хлорит калия) и для наименьшей степени окисления – приставка гипо- и суффикс –ит (KCl+1O – гипохлорит калия); ˗ в названиях анионов солей бескислородных кислот используется суффикс –ид (K2S – сульфид калия); ˗ при построении традиционных названий кислых солей к названию аниона средней соли добавляется приставка гидро- и числовая греческая приставка, если число атомов водорода в анионе больше одного (Ca(H2PO4)2 – дигидрофосфат кальция, Ca(HCO3)2 – гидрокарбонат кальция); ˗ традиционные названия основных солей формируются при помощи приставки гидроксо- и при необходимости соответствующей числительной приставки ((CuOH)2CO3 – карбонат гидроксомеди (II)).
Методика проведения опытов
4.2.1 Кислоты
4.2.1.1 Опыт №1. Получение кислоты при взаимодействии соли с кислотой Поместить в пробирку небольшое количество ацетата натрия и прибавить к нему 3 – 4 капли раствора серной кислоты. Отметить характерный запах. Какая кислота образуется? Написать уравнение реакции.
4.2.1.2 Опыт №2. Взаимодействие кислот с металлами В пробирку поместить небольшой кусочек цинка. Добавить 1 – 2 мл соляной кислоты. Объяснить наблюдения, записать уравнения реакции.
4.2.2 Соли, их получение и свойства
4.2.2.1 Опыт №3. Получение средней соли реакцией нейтрализации Налить в колбочку на 50 мл 3 мл 0,5 н раствора гидроксида натрия и прибавить одну каплю индикатора метилового оранжевого. Затем добавлять по каплям при перемешивании 0,5 н раствор соляной кислоты. Кислоту приливать до изменения цвета индикатора из желтого в оранжевый. Объясните изменение окраски индикатора. Какую реакцию среды будет иметь раствор в момент изменения окраски? Написать уравнение реакции.
4.2.2.2 Опыт №4. Получение основных солей Налить в пробирку 2 мл раствора сульфата меди (II), добавить несколько капель раствора гидроксида аммония. Выпадает зеленовато-голубой осадок основной соли (CuOH)2SO4. Написать уравнение реакции. Налить в пробирку 2 мл раствора хлорида кобальта (II), прибавить несколько капель 2 н раствора щелочи. В пробирке образуется синий осадок основной соли. При добавлении избытка щелочи образуется розовый осадок гидроксида кобальта (II). Написать уравнения реакций. 4.2.2.3 Опыт №5. Получение солей взаимодействием нерастворимого основания с кислотой К 2 мл раствора хлорида железа (III) прибавить раствор гидроксида натрия до образования осадка. К осадку прибавить по каплям раствор соляной кислоты. Объяснить наблюдаемые явления, написать уравнения реакций.
4.2.2.4 Опыт №6. Получение солей взаимодействием солей с металлами В две пробирки с растворами сульфата меди (II) и сульфата натрия поместить по небольшому кусочку цинка. Что наблюдается? Объяснить различное отношение растворов солей к цинку. Написать уравнение реакции.
4.2.2.5 Опыт №7. Получение солей взаимодействием двух солей В пробирку, содержащую 1 мл раствора нитрата или ацетата свинца добавить раствор хлорида натрия до образования осадка. Написать уравнение реакции.
4.2.2.6 Опыт №8. Получение кислых солей Через раствор гидроксида кальция (известковая вода) пропустить углекислый газ из аппарата Киппа. Наблюдать образование осадка средней соли, а затем его растворение вследствие образования кислой соли. Написать уравнения реакций. К прозрачному раствору добавить известковой воды до образования осадка. Написать уравнение реакции.
4.3 Требования к уровню подготовки студентов
˗ Знать номенклатуру основных классов неорганических соединений. ˗ Знать классификацию и взаимосвязь между основными классами неорганических соединений, способы их получения и свойства. ˗ Уметь составлять химические формулы по названию вещества и давать название веществу по его химической формуле. ˗ Уметь писать уравнения реакций, отражающих химические свойства кислот и солей. Знать условия, при которых реакции ионного обмена протекают до конца.
4.4 Задания для самоконтроля
4.4.1 Какие из ниже перечисленных веществ будут попарно взаимодействовать друг с другом? Написать уравнения реакций. а) Na[Al(OH)4]; HCl; CuO; KOH б) MgOHCl; NaOH; HCl; AgNO3 в) CO2; NaHCO3; H2SO4; NaOH г) Al; HCl; KOH; CuSO4 4.4.2 Осуществить превращения: а) P ® P2O5® H3PO4 ® Ca3(PO4)2 ® Ca(H2PO4)2 б) Ca(HCO3)2 ® CaCO3 ® CaO ® CaCl2 ® CaCO3 в) Fe ® FeCl2 ® Fe(OH)2 ® Fe(OH)3 ® [Fe(OH)2]2SO4
4.4.3 Получить всеми известными вам способами следующие соли: Al2(SO4)3; KHCO3; CuOHNO3. 4.4.4 Друг с другом в водном растворе будут взаимодействовать: а) Fe и Pb(NO3)2; б) Ca(HCO3)2 и NaOH; в) Ca(HCO3)2 и CO2; г) Na2SO4 и H3PO4. А) а, г; B) б, г; C) а, г; D) а,б 4.4.5 Выберите вариант с правильными названиями соединений, соответствующих формулам Ca(HCO3)2 и Na2S2O3: а) дигидрокарбонат кальция, дисульфат натрия; б) гидрокарбонат кальция, дисульфит натрия; в) дигидрокарбонат кальция тиосульфат натрия; г) гидрокарбонат кальция, тиосульфат натрия. 4.4.6 Какие из перечисленных кислот могут образовывать кислые соли: a)H2SO4; б) H2S; в) HClO4; г) H2CO3; д) HNO3; е) HCl? 4.4.7 Сколько формул основных солей представлено в списке: K[Al(OH)4]; Fe(OH)3; [Al(OH)2]2SO4; (CuOH)2CO3; Ca(HCO3)2; K3[Fe(CN)6]; CaSO4? 4.4.8 Выберите вариант с правильными названиями соединений, соответствующих формулам (Fe(OH)2)2SO4 и NaClO. а) сульфат дигидроксожелеза (II), гипохлорит натрия; б) сульфат гидроксожелеза (III), хлорит натрия; в) сульфат дигидроксожелеза (III), гипохлорит натрия; г) сульфат дигидроксожелеза (II), хлорат натрия.
4.5 Список рекомендуемой литературы
4.5.1 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, Лабораторная работа №5 |
||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 247. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |


 4K+ + [Fe(CN)6] 4-.
4K+ + [Fe(CN)6] 4-.