
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Изучение свойств буферных растворов потенциометрическим методом (рН-метрия)Цель работы: приготовление буферных растворов и изучение их свойств.
Оборудование и реактивы: штативы с пробирками, держатель для пробирок, индикаторы: фенолфталеин, метиловый оранжевый, лакмус, универсальная индикаторная бумага с цветной шкалой значений рН, рН-метр, 0,1М растворы уксусной кислоты, ацетата натрия, гидроксида аммония, хлорида аммония, гидроксида натрия и соляной кислоты.
10.1 Теоретические пояснения
Кислотно-основными буферными растворами называют растворы, рН которых не изменяется при разбавлении или добавлении небольших количеств сильной кислоты или сильного основания. Буферный раствор состоит из растворенных в воде слабой кислоты и ее соли, например, СН3СООН и СН3ССОNa, или из слабого основания и его соли, например, NH4OH и NH4Cl. Из слабых многоосновных кислот и их кислых солей также можно приготовить буферные системы, например, Н3РО4 – NaH2PO4 или Значения рН буферного раствора, состоящего из слабой кислоты и ее соли, рассчитывают по формуле (10.1): рН= рКНА - lg где СНА и СВА – молярные концентрации кислоты и соли соответственно в буферном растворе, моль/л; КНА – константа диссоциации кислоты;
Из уравнения (10.1) следует, что значения рН буферных растворов зависит только от отношения общих концентраций компонентов раствора и не зависит от разбавления (до определенных пределов). При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз, а отношение концентраций не изменяется. При условии СНА= СВА отношение  В действительности рН буферного раствора при сильном разбавлении несколько изменяется. Дело в том, что для более точных расчетов в уравнение (10.1) нужно подставлять вместо концентраций активности, которые связаны с концентрациями через коэффициент активности: a=f×C. Коэффициенты активности f для различных частиц будут изменяться с разбавлением по-разному, что приводит к неодинаковому изменению активностей. Главное свойство буферных смесей – противостоять изменению рН при добавлении кислоты или щелочи. Это свойство называется буферным действием. Оно – результат наличия равновесия между водой и растворенными в ней слабой кислотой (слабым основанием) и солью. Так, буферное действие ацетатного буфера, приготовленного из уксусной кислоты и ацетата натрия, объясняется тем, что при добавлении щелочи ионы ОН-- будут связываться катионами водорода кислоты с образованием воды: CH3COOH ⇆ H+ + CH3COO – H+ + OH - = H2O. При добавлении кислоты катионы водорода связываются ацетатными ионами, и образуется слабая, малодиссоциированная уксусная кислота: H+ + CH3COO - ⇆CH3COOH. Для буферных растворов, состоящих из слабого основания ВОН и его соли ВА, значение рН рассчитывают по формуле (10.2): рН=14 - рКВОН + lg Буферное действие проявляется лишь при добавлении определенных количеств кислоты или щелочи. Количество вещества эквивалентов сильной кислоты (основания), выраженное, которое необходимо прибавить к одному литру буферной смеси, чтобы изменить ее рН на единицу, называется буферной емкостью по кислоте (по основанию). Буферная емкость измеряется в моль экв./л или в ммоль экв./л. Буферная емкость зависит от природы и общих концентраций компонентов буферного раствора, а также от соотношения их концентраций. Чем больше концентрация компонентов буферного раствора и чем ближе к единице отношение Пусть Б – буферная емкость, а и b – количество вещества эквивалентов соответственно кислоты и основания, тогда справедливы формулы (10.3) и (10.4):
где Cн(К) и Cн(ОС.) – нормальные концентрации кислоты и основания соответственно, моль экв./л; VК, VОС., Vb – объемы кислоты, щелочи и буферного раствора соответственно, л; 1000 – коэффициент пересчета только для того случая, когда буферная емкость измеряется в ммоль экв./л. Буферные растворы играют большую роль в технике и природе. При проведении многих технологических процессов рН среды поддерживается постоянной с помощью буферных систем. Постоянство рН в крови и тканях живых организмов достигается за счет буферного действия карбонатной (NaHCO3 + H2CO3), отчасти фосфатной (NaH2PO4 + Na2HPO4) и белковой буферных систем. Почвенные растворы также обладают буферным действием. В почвах широко распространена буферная система из угольной кислоты и бикарбоната кальция.
10.2 Методика проведения опытов
10.2.1 Опыт №1. Приготовление буферных растворов и определение их рН Ацетатный буфер – это водный раствор уксусной кислоты и ацетата натрия, аммонийный буфер – водный раствор гидроксида аммония и хлорида аммония. В опыте предлагается приготовить по 40 мл двух буферных растворов путем смешивания равных объемов: а) 0,1М растворов уксусной кислоты и ацетата натрия; б) 0,1М растворов гидроксида аммония и хлорида аммония. С помощью рН-метра определите значения рН полученных буферных растворов. Пользуясь справочными данными для констант диссоциации и формулами (10.1) и (10.2), вычислите теоретические значения рН для приготовленных буферных растворов. Сопоставьте экспериментальные и теоретические значения рН. 10.2.2 Опыт №2. Влияние разбавления буферных смесей на значение рН В стакан на 100 мл пипеткой отмерить 1 мл ацетатной буферной смеси. Разбавить содержимое стакана в 50 раз, прилив 49 мл воды. Аналогичным образом разбавить аммонийный буфер. Используя универсальный индикатор или рН-метр (для большей точности), определить, изменилась ли реакция среды после разбавления растворов.
10.2.3 Опыт №3. Определение буферной емкости Возьмите оставшиеся неиспользованными объемы ацетатного и аммонийного буферного раствора (по 39 мл) и оттитруйте содержимое одного стаканчика 0,1н. раствором соляной кислоты, а другого – 0,1н. раствором гидроксида натрия до изменения рН на 0,3 – 0,5. Изменение рН устанавливается при помощи рН-метра. Зафиксируйте объемы прибавленных растворов кислоты и щелочи. По формулам (10.3) и (10.4) вычислите буферные емкости ацетатной и аммонийной буферных смесей по кислоте и по основанию.
10.3 Примеры решения задач
Пример 1 Вычислить [Н+], [ОН-] и рН раствора, образовавшегося в результате смешивания 30 мл 0,1М раствора уксусной кислоты СН3СООН и 50 мл 0,3М раствора ацетата калия СН3СООК. Решение Объем образовавшегося раствора V= 30+50=80 мл. Концентрации уксусной кислоты и ацетата калия после смешивания: [СН3СООН] = [СН3СООК] = Так как катионы водорода образуются только за счет диссоциации уксусной кислоты, а ацетат анионы также и за счет диссоциации ацетата калия, то, принимая за Х количество продиссоциировавшей кислоты, получим: [СН3СООН]ост = (0,0375 – Х) моль/л; [Н+]= Х моль/л; [СН3СОО-] = (0,188+Х) моль/л. Выражение для константы диссоциации уксусной кислоты:
Так как Х<< 0,0375 то его вкладом в сумму и разность предыдущего выражения можно пренебречь. Тогда Х = [H+] = 1,75·10-5·0,0375 : 0,188= 3,5·10-6 моль/л; [OH-] = 10-14 : 3,5·10-6 =2,9·10-9 моль/л; рН= -lg(3,5·10-6) = 5,46. Такой же результат может быть получен, если воспользоваться формулой (10.1) рН = рКНА - lg
Пример 2 Определить рН раствора, получившегося в результате смешения равных объемов 0,12М растворов СН3СООН и СН3СООК. Решение После смешения Скис= Ссоль= 0,12/2=0,06 моль/л рН = рКНА - lg
Пример 3 Сколько миллилитров 0,25М раствора ацетата калия СН3СООК следует прибавить к 50 мл 1,0М раствора уксусной кислоты СН3СООН, чтобы получить буферную систему с рН=3? Решение Воспользуемся формулой (10.1): рН = рКНА - lg lg
Это означает, что после смешения в полученном растворе концентрация кислоты в 57,5 раза должна быть выше, чем концентрация соли. В растворе кислоты содержится 0,05·1,0=0,05 моль кислоты. Следовательно, количество вещества соли в этом растворе должно быть в 57,5 раза меньше, а именно 0,05:57,5=0,00087 моль. Найдем объем 0,25М раствора ацетата калия: V=0,00087/ 0,25 = 0,00348 л= 3,48 мл.
Пример 4 Буферная система, состоящая из дигидрофосфата калия КН2РО4 и гидрофосфата калия К2НРО4 приготовлена при мольном соотношении солей 16:1. Определить рН данного раствора. Решение В данном случае роль слабой кислоты играет анион Н2РО4– (К2= 6,2·10-8 или рК = 7,2). рН = рКНА – lg рН = 7,2 – lg16= 6,0
Пример 5 Вычислить рН буферного раствора, содержащего 0,2 моль NH4Cl и 0,2 моль NH4ОН. Решение В соответствии с формулой (10.2), рН=14 - рКВОН + lg Так как рК(NH4ОН) = 4,755, то рН= 14 - 4,755 + lg
10.4 Требования к уровню подготовки студентов
˗ Знать понятия: буферные растворы, буферное действие, буферная емкость. ˗ Знать от чего зависит буферная емкость, уметь ее рассчитывать. ˗ Уметь готовить буферные растворы с заданным значением рН, производить необходимые для этого расчеты. ˗ Иметь представление о значении буферных растворов в природе и технике.
10.5 Задания для самоконтроля
10.5.1 Что такое буферные растворы? На чем основано их буферное действие? 10.5.2 Какое применение находят буферные растворы в быту, технике и науке? 10.5.3 Из каких веществ готовят буферные растворы? Можно ли приготовить буферный раствор исходя только из двух солей? К какому классу относятся эти соли? 10.5.4 Почему рН буферных растворов не изменяется при разбавлении? 10.5.5 Не прибегая к эксперименту, определите рН ацетатного и аммонийного буферов, при условии, что в них концентрация соли равна концентрации кислоты (основания). 10.5.6 Можно ли приготовить буферный раствор, смешивая сильную кислоту с её солью с сильным основанием или сильное основание с его солью с сильной кислотой? 10.5.7 Можно ли, исходя из одних и тех же компонентов, приготовить буферные смеси с различными значениями рН в широком диапазоне? Ответ обоснуйте на основе математического анализа соответствующей формулы. 10.5.8 Вычислить рН и рОН буферной смеси, содержащей 0,1 моль/л гидроксида аммония и 0,01 моль/л нитрата аммония. 10.5.9 Определить рН буферной смеси, состоящей из 0,01М раствора муравьиной кислоты и 0,02М раствора формиата калия. 10.5.10 Сколько граммов формиата калия НСООК следует взять, чтобы при растворении в 25 мл 0,03М раствора муравьиной кислоты НСООН, получить смесь с рН=4,0? 10.5.11 Безводный ацетат калия массой 4,9 г растворили в 250 мл 0,2н. раствора уксусной кислоты. Определить рН раствора. 10.5.12 Сколько граммов хлорида аммония нужно растворить в 20 мл 0,5М раствора гидроксида аммония, чтобы получить концентрацию гидроксид-ионов 5·10-4 моль/л. 10.5.13 Рассчитать рН буферного раствора, содержащего в 0,5 л 30 г уксусной кислоты и 41,0 г ацетата натрия. 10.5.14 Рассчитать рН и рОН раствора, если к 1,0 литру воды прибавить 11,5 г муравьиной кислоты и 10,5 г формиата калия. 10.5.15 К 100 мл аммонийной буферной смеси добавили 400 мл воды. Найти величину рОН полученного раствора, если исходный раствор имел рН = 10,2? 10.5.16 Определить рН буферного раствора, содержащего 1,1 моль/л NH4OH и 1,1моль/л NH4Cl. 10.5.17 Определить рН буферного раствора, полученного при смешении 50мл 0,1М раствора дигидрофосфата калия КН2РО4 и 25 мл 0,2М раствора гидрофосфата калия К2НРО4.
10.6 Список рекомендуемой литературы
10.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с. 10.6.2 Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. Сборник задач и упражнений по общей химии. – М.: Высш. шк., 1991. – С.138 – 140. 11 Лабораторная работа №11 Коллоидно-дисперсные системы
Цель работы: ознакомление с классификацией и номенклатурой дисперсных систем, способами получения и свойствами гидрозолей.
Оборудование и реактивы: химические стаканы, стеклянные палочки, мерные цилиндры объемом 10, 20 и 50 мл, штатив с пробирками, полоски фильтровальной бумаги (10
11.1 Теоретические пояснения
11.1.1 Классификация дисперсных систем
Дисперсные системы – это гетерогенные системы, состоящие из большого числа очень малых частиц раздробленного вещества или тончайших пор и окружающей их сплошной среды. Раздробленное вещество или поры образуют дисперсную фазу, сплошная часть системы – дисперсионную среду. Дисперсная фаза и дисперсионная среда должны быть взаимно нерастворимы. В зависимости от степени раздробленности частиц дисперсные системы подразделяются на грубодисперсные с размером частиц порядка Далее будем рассматривать только системы с жидкой дисперсионной средой. Если дисперсная фаза в грубодисперсной системе состоит из твердых частиц, то система называется взвесью или суспензией (взмученная глина в воде). Если дисперсная фаза представлена капельками жидкости, то такая система называется эмульсией (капли масла в воде, молоко). Дисперсные системы, образованные скоплением пузырей газа (пара), разделенных тонкими прослойками жидкости, называют пенами. Размер пузырей варьируется от долей миллиметра до нескольких десятков миллиметров. Устойчивость пен обусловлена присутствием в жидкой фазе пенообразователей: мыл, мылоподобных ПАВ, растворимых полимеров и других веществ. Все грубодисперсные системы малоустойчивы и склонны к разрушению. Частицы суспензий оседают под действием силы тяжести (седиментация), капельки жидкости в эмульсиях сливаются (коалесценция). Для высокодисперсных (коллоидных) систем частицы дисперсной фазы значительно больше молекул, из которых состоит дисперсионная среда. Это приводит к появлению поверхности раздела между частицами и средой. Примерами таких систем с жидкой дисперсионной средой являются коллоидные растворы (золи) и микроэмульсии. Далее по степени раздробленности идут истинные (молекулярные) растворы. Это уже гомогенные системы, в которых одно вещество распределено в другом в виде молекул, атомов или ионов. Коллоидные частицы не видны в световой микроскоп, не задерживаются бумажными фильтрами, долго не оседают. В зависимости от характера взаимодействия дисперсной фазы и дисперсионной среды коллоидные системы подразделяются на лиофобные (в случае водной дисперсионной среды гидрофобные) и лиофильные (гидрофильные). К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы не взаимодействуют или слабо взаимодействуют с дисперсной средой. Эти системы получают с затратой энергии, и они устойчивы лишь в присутствии стабилизаторов. У лиофильных коллоидов велико сродство между дисперсной фазой и дисперсионной средой. Такие системы образуются самопроизвольно, благодаря сильному взаимодействию дисперсной фазы с дисперсной средой. Примерами таких систем являются коллоидные растворы мицеллярных ПАВ. Свойства, сходные со свойствами лиофильных коллоидов, проявляют растворы высокомолекулярных соединений (ВМС) с молекулярными массами более 10000. Но эти растворы являются гомогенными системами, в них ВМС распределены в среде в виде молекул. Таким образом, растворы ВМС представляют собой истинные молекулярные растворы, там нет поверхности раздела фаз. В современной классификации термин «коллоид» относится только к микрогетерогенным системам, каковыми растворы ВМС не являются. Сходство свойств растворов ВМС и лиофильных коллоидов объясняется тем, что размеры макромолекул ВМС сопоставимы с размерами коллоидных частиц.
11.1.2 Методы получения гидрофобных золей
Методы получения гидрофобных золей подразделяются на три группы: методы диспергирования (измельчение вещества до частиц коллоидных размеров), методы пептизации (разъединение слипшихся частиц), методы конденсации (объединение атомов, молекул или ионов в коллоидные частицы). К методам диспергирования относятся: механическое дробление в коллоидных мельницах, применение для измельчения вещества ультразвука и вольтовой дуги. Образующиеся частицы имеют тенденцию к слипанию (коагуляции), поэтому дробление ведут в дисперсионной среде в присутствии стабилизаторов (электролиты или ПАВ). Типичным примером является введение различных пластификаторов при получении бетона, приводящее к увеличению срока схватывания бетона и его текучести. При пептизации (физико-химическое дробление) не происходит изменения степени дисперсности частиц. Ионы пептизатора адсорбируются на поверхности коллоидных частиц, заряжая их одноименно, что обеспечивает электростатическое отталкивание и переход частиц во взвешенное состояние. Так образуется золь. Типичным примером пептизации является образование золя гидроксида железа (III) при действии на студенистый осадок Fе(ОН)3 раствора FеС13. Конденсация бывает физическая и химическая. Физическая конденсация может быть осуществлена при пропускании паров одного вещества (дисперсная фаза) в другое (дисперсионная среда) в присутствии стабилизатора, либо методом замены растворителя: раствор какого-либо вещества постепенно прибавляют при перемешивании к жидкости, в которой это вещество нерастворимо. При этом происходит конденсация молекул и образование коллоидных частиц. Так получают гидрозоли серы, фосфора, канифоли, антрацена при вливании их спиртовых растворов в воду. Гидрофобные золи можно получить и методом химической конденсации. Если в результате химической реакции образуется трудно растворимое соединение, то оно при определенных условиях может быть получено в виде коллоидного раствора. Для этого нужно, во-первых, проводить реакцию в разбавленном растворе, чтобы скорость роста кристаллических частиц была невелика, тогда частицы получаются мелкие (10-7-10-9м), во-вторых, необходимо одно из реагирующих веществ взять в избытке, чтобы на поверхности кристалла мог образоваться двойной электрический слой – основной фактор агрегативной устойчивости. Кристалл вместе с двойным электрическим слоем (ДЭС) называется мицеллой. Рассмотрим строение мицеллы лиофобного золя на примере образования коллоидного раствора иодида серебра при сливании разбавленных растворов нитрата серебра и иодида калия, причем KI взят в избытке и выполняет функцию стабилизатора. Иодид серебра образуется в результате обменной реакции: AgNO3+KI=AgI¯+KNO3. Микрокристалл малорастворимого иодида серебра, состоящий из m частиц AgI, называется агрегатом. Агрегат формируют только частицы малорастворимого вещества. На поверхности агрегата могут избирательно адсорбироваться ионы из раствора, причем в первую очередь адсорбируются те из них, которые присутствуют в избытке и родственны составу агрегата (правило Панета-Фаянса). В нашем примере – это анионы I–. Их называют потенциалопределяющими ионами. Допустим их n. Агрегат вместе с потенциалопределяющими ионами является частицей твердой фазы и называется ядром. За счет электростатического притяжения анионы I– будут удерживать возле себя катионы калия, которые также присутствуют в избытке. Эти катионы называются противоионами. Противоионы, наиболее близко расположенные к ядру, находятся в слое жидкости, смачивающей его поверхность, и испытывают не только электростатическое, но и ван-дер-ваальсово притяжение ядра. Поэтому эти ионы наиболее прочно связаны с ядром. Они называются противоионами адсорбционной сферы. Однако их количество недостаточно для полной нейтрализации суммарного заряда потенциалопределяющих ионов. Образование, состоящее из ядра и адсорбционной сферы противоионов, носит название коллоидной частицы или гранулы. Она несет заряд, равный алгебраической сумме зарядов ионов адсорбционной сферы. Остальные противоионы, слабее связанные с ядром, под действием теплового движения располагаются в жидкой фазе диффузно, то есть размыто. Они образуют диффузную сферу, нейтрализуя заряд коллоидной частицы. Гранула в совокупности с диффузной сферой противоионов образуют мицеллу. Мицелла электронейтральна. Схематично строение мицеллы рассматриваемого золя приведено на рисунке 11.1.
{[AgI]m, n I–, (n-x) K+}x – x K+
ионы сферы сферы
коллоидная частица (гранула)
мицелла
Рисунок 11.1 – Схема строения мицеллы золя AgI при избытке KI
Если рассматриваемую реакцию проводить в условиях избытка AgNO3, то формируется другой ДЭС. Тогда формула мицеллы выглядит следующим образом: {[AgI]m, n Ag+, (n-x) NO3–}x+ x NO3– При движении дисперсной фазы относительно дисперсионной среды граница скольжения проходит вблизи раздела между адсорбционным и диффузным слоем противоионов. То есть гранула движется как целое, а диффузный слой противоионов непрерывно переформировывается во время движения.
11.1.3 Коагуляция
Процесс укрупнения коллоидных частиц в результатеих слипания под действием межмолекулярных сил притяжения называется коагуляцией. Процессу коагуляции золя способствуют вибрация, нагревание, замораживание, пропускание электрического тока, длительное стояние (старение золя), прибавление электролита. Под действием электролита наиболее легко коагулируют золи, у которых основным фактором устойчивости является ДЭС. Коагуляция сопровождается помутнением золя, образованием хлопьев осадка или геля (дисперсной системы с жидкой дисперсионной средой, в которой мицеллы образуют пространственную структурную сетку). Коагуляцию вызывают ионы электролита, несущие заряд, противоположный по знаку заряду коллоидной частицы. В соответствии с правилом Шульце–Гарди, коагулирующее действие электролита сильно возрастает с ростом заряда иона-коагулятора. Минимальная концентрация электролита (может выражаться в моль/л, ммоль/л, кмоль/м3), вызывающая быструю (явную) коагуляцию золя, называется порогом коагуляции. Порог коагуляции СК, выраженный в моль/л, может быть рассчитан по формуле: где С(1/zX) – молярная концентрация эквивалента электролита Х, моль/л; VЭЛ.. и VЗ – объемы электролита и золя соответственно, л. Если принять порог коагуляции трехзарядного иона за единицу, то для соотношения порогов коагуляции ионов с различными зарядами можно записать приближенно: СK(z=1):CK(z=2):CK(z=3)»700:10:1 Порог коагуляции СК определяют визуально при титровании золя растворами электролитов до начала явной коагуляции или по зависимости оптической плотности золя от концентрации введенного электролита. К моменту достижения порога коагуляции оптическая плотность исследуемой системы резко увеличивается. При сливании коллоидных растворов с противоположными зарядами частиц, может происходить взаимная коагуляция.
11.2 Методика проведения опытов
11.2.1 Опыт №1. Получение золя оксида марганца (IV)
Золь оксида марганца (IV) предлагается получить двумя способами. 11.2.1.1 В химическом стакане проводят реакцию: 2KMnO4 + 2NH4OH = 2MnO2 + 2KOH + N2 + 4H2O. Для этого к 50 мл воды нужно добавить 1мл 5% раствора КМnО4 и нагреть до кипения. К горячему раствору добавить 7,5мл концентрированного раствора NH4OH (работу выполняют в вытяжном шкафу) порциями по 0,5 мл. После прибавления каждой порцииаммиака смесь перемешивают и вновь доводят до кипения. Образуется золь красно-коричневого цвета. Результаты опыта и выводы занести в таблицу 11.1. Сохранить полученный золь для последующих опытов. Таблица 11.1 – Результаты опытов №1 – №3
11.2.1.2 В химическом стакане проводят реакцию: 2KMnO4 + 2Nа2S2O3 + 4H2O = 2MnO2+2KOH + 3Na2S4O6 + 6 NaOH Для этого к 1 мл 5% раствора КMnО4 нужно добавить 19 мл воды. Затем при взбалтывании к полученной смеси добавить 5-6 капель 2% раствора Nа2S2O3. Образуется золь темно-коричневого цвета. Результаты опыта и выводы занести в таблицу 11.1. Сохранить полученный золь для последующих опытов.
11.2.2 Опыт №2. Получение золя берлинской лазури
В основе получения лежит реакция FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl К 20 мл воды добавить 2-3 капли насыщенного на холоде раствора FeCl3 и при взбалтывании добавить 1 каплю 4% раствора гексацианоферрата (II) калия K4[Fe(CN)6]. Образуется золь сине-зеленого цвета. Результаты опыта и выводы занести в таблицу 11.1. Сохранить полученный золь для последующих опытов.
11.2.3 Опыт №3. Получение золя гидроксида железа (III)
В основе получения лежит реакция FeCl3 + 3H2O = Fe(OH)3¯ + ЗНС1 К 20 мл кипящей воды прибавить 1-2 капли насыщенного раствора FeCl3. Образуется золь вишнево-красного цвета. Результаты опыта и выводы занести в таблицу 11.1. Сохранить полученный золь для последующих опытов.
11.2.4 Опыт №4. Определение заряда коллоидных частиц
Определите заряд коллоидных частиц в опытах №1 – №3 исходя из методики получения золя и химизма процесса. Подтвердите правильность определения заряда экспериментальным методом. Для этого можно использовать электрофорез. В стеклянную U-образную трубку поместите золь и в оба ее колена введите электроды. Присоедините электроды к источнику постоянного тока. Через 5-10 минут ток отключите. У электрода, заряженного одноименно с коллоидными частицами, должна наблюдаться зона просветления. Определить заряд коллоидных частиц можно также капиллярным анализом. Для проведения капиллярного анализа налейте 5-10 мл окрашенных золей из предыдущих опытов в стаканы и опустите в них полоски фильтровальной бумаги. Верхние концы полосок крепятся кнопками к деревянной планке, зафиксированной в лапке штатива. Важно не допускать соприкосновения полосок с дном и стенками стаканов. Через 5 минут вынуть полоски из стаканов и наблюдать характер распределения окрашенных и неокрашенных зон на бумаге. При смачивании фильтровальной бумаги под действием сил поверхностного натяжениявода поднимается по капиллярам бумаги. При этом стенки капилляра заряжаются отрицательно, а граничащая с ними вода – положительно. Если вместо воды взять гидрозоль, то его заряженные коллоидные частицы смогут передвигаться вверх по полоске мокрой бумаги только в том случае, когда они заряжены отрицательно (одноименно со стенками капилляра). Положительно заряженные частицы золя будут притягиваться отрицательно заряженными стенками капилляров и оседать на них. При этом на бумаге будут видны две зоны: окрашенная и неокрашенная.
11.2.5 Опыт №5. Определение порога коагуляции золя
В 6 пробирок одинакового диаметра налить из бюретки по 5 мл одного из золей, приготовленных в предыдущих опытах (по указанию преподавателя). Сначала проведите коагуляцию золя электролитом с однозарядным В качестве коагуляторов можно использовать водные растворы: 2М NaNO3; 2,5М КС1; 0,001М ВаСl2; 0,01М Ва(N03)2; 0,0001М Сr(NО3)3; 0,01М А1С13; 0,05М K3[Fe(CN)6]; 0,001М А1(NО3)3; 0,1М К2SO4. Взять в руки две пробирки c золем и прибавлять каплями из бюреток в одну – электролит, в другую (контрольную) – такое же число капель воды. После каждого прибавления пробирки встряхивать, сравнивая титруемый золь с контрольным до появления визуальных признаков коагуляции (помутнение или образование хлопьев осадка). Для каждого электролита-коагулятора зафиксируйте объем израсходованного раствора, рассчитайте порог коагуляции по формуле 11.1. Занесите данные в таблицу 11.2. Объясните данные опыта с позиций правила Шульце-Гарди. Определите заряд иона-коагулятора и заряд коллоидных частиц золя. Сопоставьте полученные данные с данными опыта №4. Таблица 11.2 – Данные опыта №5
11.3 Примеры решения задач
Пример 1 Пороги коагуляции золя электролитами оказались равными (моль/л): Cк(NaNO3)=0,25; Cк(Fe(NO3)3)=0,0005; Cк(Mg(NO3)2)=0,02. Определите ионы-коагуляторы для этих электролитов. Как заряжены частицы золя? Решение Все применяемые в качестве коагулянтов электролиты содержат нитрат-анион. Если бы коагулирующей способностью обладали анионы коагулянта, то пороги коагуляции для всех электролитов были бы одинаковыми. Однако, в ряду Na+, Mg2+, Fe3+ значения порогов коагуляции резко уменьшаются. То есть, с ростом заряда катиона коагулянта порог коагуляции падает. Как известно, коагулирующей активностью обладают ионы, противоположно заряженные по отношению к коллоидным частицам, поэтому можно заключить, что коллоидные частицы изучаемого золя имеют отрицательный заряд.
Пример 2 Золь кремниевой кислоты Н2SiO3 был получен при взаимодействии растворов К2SiO3 и HCI. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду? Решение Золь получают методом химической конденсации по реакции К2SiO3 + 2HCI = Н2SiO3¯+2KCl Если противоионы коллоида движутся к катоду, то они имеют положительный заряд, а коллоидная частица – отрицательный. Следовательно, потенциалопределяющими ионами в процессе мицеллообразования являются отрицательно заряженные анионы SiO32-, и в избытке был взят силикат калия. Мицелла имеет формулу, приведенную ниже: {[H2SiO3]m; n SiO32–; 2(n-x) K+}2x – 2x K+ Пример 3 Какой объем 0,0025М КI надо добавить к 0,035л 0,003н. Рb(NO3)2, чтобы получить золь иодида свинца, и при электрофорезе коллоидные частицы двигались бы к аноду. Напишите формулу мицеллы золя. Решение: Золь получают методом химической конденсации по реакции 2КI+ Рb(NO3)2= PbI2¯+2KNO3 Из условия следует, что коллоидные частицы заряжены отрицательно. Значит, при образовании золя в избытке был взят иодид калия. Мицелла имеет формулу {[PbI2]m, n I–, (n-x) K+}x – x K+ К раствору Рb(NO3)2 нужно добавить такой объем раствора КI, который бы превышал эквивалентный объем. Пользуясь законом эквивалентов, можно рассчитать объем раствора КI в точке эквивалентности. V1C1(1/z) = V2C2(1/z). V(KI)=V(Рb(NO3)2) · C(1/z Рb(NO3)2) : C(1/z KI) = 0,035·0,003:0,0025=0,042 л Итак, объем 0,0025М КI должен превышать 0,042 л.
11.4 Требования к уровню подготовки студентов
˗ Знать понятия: золь, гель, лиофильные и лиофобные коллоиды, коагуляция, порог коагуляции, пептизация. ˗ Иметь представление о методах получения лиофобных золей. ˗ Уметь изображать схемы строения мицелл лиофобных золей в зависимости от условий получения золей. ˗ Уметь рассчитывать порог коагуляции.
11.5 Задания для самоконтроля
11.5.1 Какие ионы являются потенциалобразующими в коллоидной частице золя: а) гидроксида железа (Ш), содержащем избыток FeCl3; б) сульфида сурьмы, содержащем избыток Na2S? 11.5.2 Запишите формулу мицеллы золя: а) гидроксида железа (Ш) при смешении раствора хлорида железа (Ш) с менее концентрированным раствором гидроксида натрия. 11.5.3 Перечислите, какие методы коагуляции вам известны? В чем заключается явление коагуляции? 11.5.4 Что называют эффектом Тиндаля? Как используется этот эффект для идентификации коллоидных растворов? 11.5.5 Перечислите известные вам методы получения коллоидных растворов, опишите их суть. 11.5.6 Почему образование гидрозоля не происходит, если смешать эквивалентные количества электролитов? 11.5.7 Что такое взаимная коагуляция? При каких условиях она возможна? Приведите практический пример такой коагуляции. 11.5.8 Как определить заряд иона-коагулятора, если известен заряд коллоидных частиц? 11.5.9 Напишите формулу мицеллы сульфата бария, полученного сливанием равных объемов раствора BaCl2 и менее разбавленного раствора Н2SO4. 11.5.10 Какой объем 0,001М AsCl3 надо добавить к 0,02 л 0,003М H2S, чтобы не произошло образование золи сульфида мышьяка, а выпал осадок As2S3? 11.5.11 Напишите формулу мицеллы золя бромида серебра, полученного при взаимодействии разбавленного раствора нитрата серебра с избытком бромида натрия. Какой заряд имеет коллоидная частица? Как изменится этот заряд, если в избытке окажется нитрат серебра? 11.5.12 Золь иодида серебра получен добавлением к 20 мл раствора KI (СМ=0,01 моль/л) 28 мл раствора AgNO3 (CМ=0,005 моль/л). Напишите формулу мицеллы полученного золя и определите направление движения гранулы золя при электрофорезе. 11.5.13 Свежеполученный и очищенный осадок Fe(OH)3 разделили на две части. К первой части добавили небольшое количество FeCl3, а к другой – НСl. В обоих случаях образовался золь гидроксида железа (III). Напишите формулы мицелл золя. Какой заряд будут иметь гранулы? 11.5.14 Какой объем 0,0002М Fe(NO3)2 требуется для коагуляции 0,025 л золя сульфида мышьяка (III), если порог коагуляции равен 0,067 ммоль/л? 11.5.15 Золь кремниевой кислоты H2SiO3 был получен при взаимодействии раствора K2SiO3 и HCl. Напишите формулу мицеллы золя и определите, какой из электролитов был взят в избытке, если противоионы в электрическом поле движутся к катоду? 11.5.16 Пороги коагуляции электролитов для некоторого гидрозоля равны: С(NaNO3)=300 ммоль/л; C(MgCl2)=25 ммоль/л; C(Na2SO4)=295 ммоль/л; C(AlCl3)=0,5 ммоль/л. Какой заряд несут гранулы золя? 11.5.17 Напишите формулы мицелл золей иодида серебра, полученного при взаимодействии разбавленных растворов AgNO3 и KI при условиях: а) KI в избытке; б) KI в недостатке.
11.6 Список рекомендуемой литературы
11.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с. 11.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с. 11.6.3 Л.Н.Романцева, З.Л.Лещинская, В.А.Суханова. Сборник задач и упражнений по общей химии. – М.: Высш. шк., 1991. – С.152 – 153.
12 Лабораторная работа №12 Окислительно-восстановительные реакции
Цель работы: ознакомление с окислительно-восстановительными свойствами металлов, неметаллов и их соединений; освоение методики составления уравнений окислительно-восстановительных реакций.
Оборудование и реактивы: 0,1М раствор Н2SO4, 0,5н. раствор СuSO4, разбавленные растворы KMnO4 и К4[Fe(CN)6], имеющие не очень интенсивную окраску, 2М растворы КОН и NaOH, кристаллические Na2SO3 и иод, Zn, Mg, Fe (опилки), Cu (стружки), металлическая скрепка (кнопка), штатив, пробирки, держатель для пробирок, дистиллированная вода, спиртовка, спички, бромная вода.
12.1 Теоретические пояснения
Реакции, протекание которых связано со смещением или полным переходом электронов от одних атомов или ионов к другим, называются окислительно-восстановительными. Число электронов, смещенных от атома (иона) данного элемента к другим атомам (ионам) в соединении, называют степенью окисления. Степень окисления может быть положительной (электроны смещены от атома или иона) и отрицательной (электроны смещены к атому или иону). Процесс отдачи электронов называют окислением. Степень окисления элемента при этом повышается. Вещества, отдающие электроны, называют восстановителями. К типичным восстановителям относятся простые вещества, атомы которых характеризуются невысокой электроотрицательностью (металлы, водород, углерод), некоторые анионы (CI-, S2-, SO32- и другие), катионы, у которых степень окисления может возрастать (Fe2+, Sn2+ и другие), некоторые соединения углерода, азота, бора и другие. Процесс присоединения электронов, то есть понижение степени окисления, называют восстановлением, а вещества, принимающие электроны, называют окислителями. К окислителям относятся простые вещества, атомы которых характеризуются высокой электроотрицательностью (элементы VI и VII групп главных подгрупп), катионы с высокой степенью окисления (Pb+4, Cr+6, Ge+4), анионы, в которых электроположительный элемент имеет высокую степень окисления (NO3-, Cr2O72-, MnO4- и другие), высшие оксиды, а также пероксиды. Окислительно-восстановительные реакции – это единство одновременно протекающих процессов окисления и восстановления. Реакции, в которых окислители и восстановители представляют собой разные вещества, называют межмолекулярными. Если окислителем и восстановителем служат разные атомы или ионы в составе одного и того же вещества, то такие реакции называют внутримолекулярными. В реакциях диспропорционирования (самоокисления-самовосстановления) атомы одного и того же элемента в составе одного и того же вещества выполняют функции окислителя и восстановителя. Направление окислительно-восстановительных реакций определяется вторым законом термодинамики. Если процесс протекает при изобарно-изотермических условиях, то прямая реакция возможна при условии, что ее энергия Гиббса меньше нуля, ΔGреакции<0. Окислительно-восстановительную способность вещества определяет величина окислительно-восстановительного потенциала (редокс-потенциал) для полуреакции восстановления. Окислительная способность веществ тем выше, чем больше положительное значение окислительно-восстановительного потенциала. В общем виде полуреакцию восстановления можно записать в виде
где Ox – окисленная форма веществ; Red – восстановленная форма веществ; n – число электронов, принимающих участие в полуреакции. Если реакция протекает в условиях, отличных от стандартных, то для расчета окислительно-восстановительного потенциала используют уравнение Нернста, которое при температуре 298К имеет следующий вид:
где
Если в окислительно-восстановительных реакциях участвуют ионы водорода или гидроксид-ионы, то окислительно-восстановительные потенциалы зависят от величины рН. Например, для полуреакции NO3- + 3H+ + 2e- = HNO2 + H2O
Окислительно-восстановительная реакция может протекать в заданном направлении самопроизвольно лишь тогда, когда потенциал окислителя больше потенциала восстановителя. Только в этом случае выполняется условие ΔGреакции<0. Действительно, если процессы окисления и восстановления разъединить в пространстве, проводя их у электродов гальванического элемента, то будет совершаться электрическая работа
где n – число электронов, участвующих в реакции; F – постоянная Фарадея; Итак, чтобы
12.2 Методика проведения опытов
12.2.1 Опыт №1. Восстановительные свойства металлов
12.2.1.1 Восстановление катионов Н+ металлами В три пробирки налейте по 2-3 мл 0,1 М раствора серной кислоты. В одну пробирку внесите магний или цинк, во вторую – железо, в третью – медь. Запишите наблюдения, составьте уравнения протекающих реакций и объясните результаты опыта. Укажите окислитель и восстановитель.
12.2.1.2 Восстановление катионов меди металлическим железом Прилейте в пробирку 3-5 мл 0,5н. раствора сульфата меди (II) и погрузите в него металлическую скрепку (кнопку). Через 2 минуты выньте скрепку. Что образовалось на ее поверхности? Для каких практических целей служит данная реакция? Какими химическими свойствами обладают все металлы? Приведите три примера катионов металлов с наиболее выраженными окислительными свойствами.
12.2.2 Опыт №2. Влияние pH среды на окислительно-восстановительные реакции
12.2.2.1 Восстановление перманганата калия сульфитом натрия В три пробирки налейте по три миллилитра раствора перманганата калия. В первую пробирку прилейте 2 мл 1М раствора серной кислоты, во вторую 2 мл Н2О, в третью 2 мл 2М раствора КОН. В каждую пробирку добавьте несколько кристалликов сульфита натрия. Запишите наблюдения, составьте уравнения окислительно-восстановительных реакций и объясните результаты опыта. Учтите, что фиолетовая окраска характерна для ионов MnO4–, слабо-розовая (бесцветная) – для ионов Mn2+, бурый цвет имеют осадки МnО2 и Мn(ОН)2, манганат-ионы MnO42– имеют зеленую окраску.
12.2.2.2 Окисление Fe2+ до Fe3+ в кислой и щелочной среде К свежеприготовленному раствору FeSO4, полученному растворением взятых в избытке опилок железа в разбавленной серной кислоте, прилейте раствор гидроксида натрия. Что наблюдается? Что происходит после взаимодействия полученного осадка с кислородом воздуха? Составьте уравнения реакций и объясните результаты опыта. К свежеприготовленному раствору FeSO4 добавьте 2 мл 1М раствора серной кислоты и несколько капель бромной воды. В пробирку добавьте 2 капли раствора К4[Fe(CN)6]. Запишите наблюдения, составьте уравнение окислительно-восстановительной реакции и объясните результаты опыта.
12.2.3 Опыт №3 Реакции диспропорционирования
Кристаллик иода обработайте небольшим количеством 2М раствора гидроксида натрия при слабом нагревании. Полученный раствор подкислите. Запишите наблюдения, составьте уравнение окислительно-восстановительной реакции, учитывая, что образуется иодат и иодид натрия.
12.3 Примеры решения задач
Пример 1 Определите степень окисления серы в соединениях: Н2S, Na2S2O3, H2SO3, H2SO4. Решение При определении степени окисления элемента в соединении исходят из предпосылок: - молекула в целом электронейтральна; - все связи в молекуле между разными по природе элементами – ионные; - из двух соседствующих атомов отрицательный заряд приобретает тот, который более электроорицателен; - степень окисления элементов в простых веществах равна нулю; - атом водорода в соединениях имеет степень окисления +1, кроме гидридов, где водород имеет степень окисления -1; - степень окисления кислорода в соединениях, кроме перекисных соединений и соединений с фтором, всегда равна -2; - степень окисления фтора в соединениях равна -1; - степень окисления щелочных металлов в соединениях равна +1; - степень окисления щелочноземельных металлов в соединениях равна +2 Определим степень окисления серы в перечисленных соединениях. (Н+12Sх)0 2(+1) + х = 0 х = -2.
(Na+12Sх2O-23)0 2(+1) + 2х + 3(-2) =0, х= +2.
(H+12SхO-23)0 2(+1) + х + 3(-2) =0 х= +4.
(H+12SхO-24)0 2(+1) + х + 4(-2) =0, х= +6.
Пример 2 Методами электронного баланса и полуреакций (метод электронно-ионного баланса) расставить коэффициенты в межмолекулярной окислительно-восстановительной реакции FeSO4 + KMnO4 + H2SO4 "Fe2(SO4)3 + MnSO4+ K2SO4 + H2O Решение Определив степени окисления элементов в составе соединений, участвующих в ОВР можно убедиться, что железо (II) окисляется до железа (Ш), а марганец (VII) восстанавливается до марганца (II). Fe+2 – 1е- " Fe+3, Mn+7 + 5е- " Mn+2 Метод электронного баланса предусматривает уравнивание количества электронов в процессах окисления и восстановления. Так как в продуктах реакции имеем два атома железа, то это необходимо учесть в электронном балансе 2Fe+2 – 2е- " 2Fe+3 ´ 5
10Fe+2 + 2Mn+7 " 10Fe+3 + 2Mn+2 Перенеся соответствующие коэффициенты в уравнение реакции, получим: 10FeSO4 + 2KMnO4 + H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O Коэффициент перед серной кислотой можно вычислить как разницу между количеством сульфат-анионов в продуктах и исходных веществах: (3´5 + 2 + 1) – 10 = 8 10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O Коэффициент для воды, равный 8, получим, исходя из числа катионов водорода в серной кислоте. Таким образом, можно написать окончательное уравнение окислительно-восстановительной реакции: 10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + 8H2O Теперь применим к указанной реакции метод полуреакций, он еще называется методом электронно-ионного баланса. Для составления уравнений окислительно-восстановительных реакций, протекающих в водных растворах, предпочтительно использовать именно этот метод. В нем рассматриваются частицы, реально существующие в растворе, видна роль среды, не обязательно знать все образующиеся вещества, недостающие продукты реакции сами появляются при выводе уравнения реакции. При составлении уравнений окислительно-востановительных реакций методом электронно-ионного баланса рекомендуется придерживаться определенного алгоритма. - На основании знания свойств веществ, вступающих в реакцию, определяются окислитель, восстановитель и продукты их превращения. - Составляются схемы полуреакций окисления и восстановления, в которых указываются реально существующие в растворе частицы. - Уравнивается число атомов элементов в схемах полуреакций. При необходимости для этого используются частицы, существующие в водных растворах: Н2О, Н+, ОН –. Необходимо учитывать, что в кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение недостающего кислорода в кислых и нейтральных средах происходит за счет молекул воды и приводит к образованию ионов водорода, в то время как в щелочной среде присоединение кислорода идет за счет гидроксид-ионов с образованием молекул воды. - Учитывается правило электронейтральности: сумма зарядов в левой и правой части полуреакции должна быть одинакова. Для этого нужно прибавить или отнять от левой части полуреакции соответствующее число электронов. Оно определяется как разность между суммарными зарядами в левой и правой части полуреакции. - Уравнивается число электронов, отданных восстановителем и принятых окислителем. Для этого вводятся соответствующие коэффициенты для полуреакций. - Складываются левые и правые части полуреакций. Таким образом, получают ионно-молекулярное уравнение окислительно-восстановительной реакции. - Записывается уравнение реакции в молекулярной форме. При этом учитываются частицы, не принимавшие участия в окислительно-восстановительном процессе, но присутствующие в растворе.
(MnO4)2 - + 8Н+ + 5е- " Mn2+ + 4 H2O ´2
10FeSO4 + 2KMnO4 + 8H2SO4 " 5Fe2(SO4)3 + 2MnSO4+ K2SO4 + 8H2O
Пример 3 Закончите реакцию и расставьте коэффициенты методом электронного баланса. Na2SO3 + KMnO4 + KOH " Na2SO4 + … Решение В данной реакции Na2SO3 является восстановителем, так как S+4 -2е- " S+6, KMnO4 – окислитель. Известно, что в зависимости от рН среды Mn+7 может восстанавливаться
Так как в нашем случае реакция протекает в присутствии щелочи, то есть рН>7, то продуктами реакции будут К2MnO4 и вода. Na2SO3 + KMnO4 + KOH " Na2SO4 + К2MnO4 + H2O Расставим коэффициенты методом электронного баланса:
S+4 - 2е-" S+6 ´1
Na2SO3 + 2KMnO4 + 2KOH " Na2SO4 + 2К2MnO4 + H2O
12.4 Требования к уровню подготовки студентов
- Знать понятия: степень окисления элемента, окислитель, восстановитель, окислительно-восстановительная реакция. - Знать наиболее распространенные окислители и восстановители. - Уметь связывать окислительно-восстановительные свойства веществ со степенью окисления образующих их атомов элементов. - Уметь составлять уравнения окислительно-восстановительных реакций и расставлять в них коэффициенты, используя метод электронного баланса и метод полуреакций.
12.5 Задания для самоконтроля
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 252. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
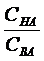 , (10.1)
, (10.1)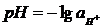 ;
;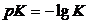 .
.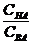 =1, и lg
=1, и lg 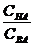 =0, то есть, рН= рКНА.
=0, то есть, рН= рКНА.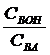 (10.2)
(10.2)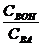 (в случае основных буферов), тем больше буферная емкость. Буферная емкость максимальна, когда вышеприведенные отношения равны единице.
(в случае основных буферов), тем больше буферная емкость. Буферная емкость максимальна, когда вышеприведенные отношения равны единице.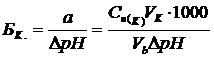 (10.3)
(10.3)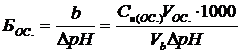 , (10.4)
, (10.4)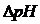 – изменение рН при добавлении данного количества кислоты или основания;
– изменение рН при добавлении данного количества кислоты или основания;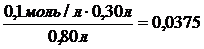 моль/л,
моль/л,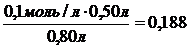 моль/л.
моль/л.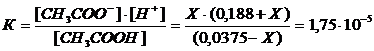
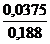 = 4,76 – (-0,7) = 5,46.
= 4,76 – (-0,7) = 5,46.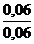 = 4,76 – lg1 = 4,76 - 0 = 4,76.
= 4,76 – lg1 = 4,76 - 0 = 4,76.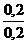 = 9,25.
= 9,25. 100 мм), стеклянная U-образная трубка, источник постоянного тока (плоские батарейки на 4,5В), насыщенный раствор хлорида железа (III), концентрированный гидроксид аммония, разбавленные растворы KМnO4; Na2S2O3; К3[Fe(CN)6]; К4[Fe(CN)6]; NaNO3; КС1; ВаСl2; Ва(NO3)2; Сr(NО3)3; А1С13; K3[Fe(CN)6]; А1(NO3)3; К2SO4.
100 мм), стеклянная U-образная трубка, источник постоянного тока (плоские батарейки на 4,5В), насыщенный раствор хлорида железа (III), концентрированный гидроксид аммония, разбавленные растворы KМnO4; Na2S2O3; К3[Fe(CN)6]; К4[Fe(CN)6]; NaNO3; КС1; ВаСl2; Ва(NO3)2; Сr(NО3)3; А1С13; K3[Fe(CN)6]; А1(NO3)3; К2SO4.


 агрегат потенциал- противоионы противоионы
агрегат потенциал- противоионы противоионы



 определяющие адсорбционной диффузной
определяющие адсорбционной диффузной ядро
ядро

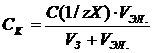 , (11.1)
, (11.1)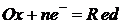 ,
,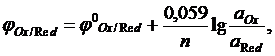 (12.1)
(12.1)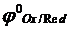 – стандартный окислительно-восстановительный потенциал (справочная величина);
– стандартный окислительно-восстановительный потенциал (справочная величина);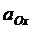 ,
, 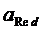 – произведения активностей соответственно окисленной и восстановленной форм веществ в степенях, равных стехиометрическим коэффициентам в уравнении полуреакции.
– произведения активностей соответственно окисленной и восстановленной форм веществ в степенях, равных стехиометрическим коэффициентам в уравнении полуреакции.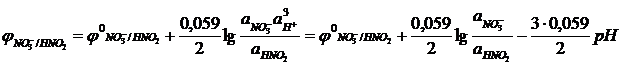
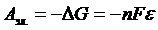 ,
,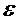 – ЭДС гальванического элемента.
– ЭДС гальванического элемента.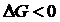 , необходимо, чтобы
, необходимо, чтобы 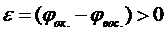 , то есть
, то есть 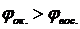 .
. .
. Mn+7 + 5е- " Mn+2 ´ 2
Mn+7 + 5е- " Mn+2 ´ 2 10Fe2+ + 2(MnO4)2 - + 16Н+ " 10Fe3+ + 5 Mn2+ + 8H2O
10Fe2+ + 2(MnO4)2 - + 16Н+ " 10Fe3+ + 5 Mn2+ + 8H2O
 рН >7 (MnO4)2– (зеленая окраска раствора)
рН >7 (MnO4)2– (зеленая окраска раствора)
 Mn+7 рН=7 MnO2 (бурый осадок)
Mn+7 рН=7 MnO2 (бурый осадок) рН< 7 Mn2+ (обесцвечивание первоначального раствора)
рН< 7 Mn2+ (обесцвечивание первоначального раствора)