
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Электрохимический ряд напряжений металлов. Коррозия металловЦель работы: ознакомиться на опыте с зависимостью окислительно-восстановительных свойств металлов от их положения в ряду стандартных электродных потенциалов; ознакомиться с некоторыми моделями возникновения коррозионных элементов. Оборудование и реактивы: пробирки, держатели для пробирок, спиртовка, фильтровальная бумага, пипетки, 2н. растворы HCl и H2SO4, концентрированная H2SO4, разбавленная и концентрированная HNO3, 0,5М растворы CuSO4, Pb(NO3)2 или Pb(CH3COO)2; 0,1М раствор K3[Fe(CN)6], кусочки металлических алюминия, цинка, железа, меди, олова, железные канцелярские скрепки, дистиллированная вода.
13.1 Теоретические пояснения
13.1.1 Электрохимический ряд напряжений металлов
Если пластинку металла погрузить в раствор его соли, то под действием диполей воды ионы металла, находящиеся в узлах кристаллической решетки, гидратируются и переходят в раствор, оставляя в металле избыточные электроны. Но одновременно происходит обратный процесс: ионы металла из раствора переходят на пластинку (будем называть ее электродом) и разряжаются, превращаясь в атомы металла. В конце концов, скорости этих двух процессов выравниваются, и между металлом и его ионами в растворе устанавливается равновесие: Men++ne- ⇆ Me. На границе металл-раствор возникает двойной электрический слой. Поверхность металла имеет один заряд, а примыкающий к ней раствор заряжается противоположно. Двойной электрический слой характеризуется разностью потенциалов. Знак и величина потенциала электрода будет зависеть от природы металла, концентрации его ионов в растворе, температуры.  Абсолютное значение электродного потенциала j отдельного электрода экспериментально определить нельзя, его измеряют относительно другого электрода, потенциал которого известен. Условились принимать потенциал стандартного водородного электрода равным нулю. Стандартный водородный электрод представляет собой платиновую пластинку, покрытую губчатой платиной, погруженную в раствор кислоты с активностью ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом при давлении 1 атм. и температуре 298 К. При этом устанавливается равновесие: 2Н++2 е - ⇆ Н2 Если стандартный водородный электрод связать через электролитический ключ с раствором соли металла, в который погружена пластинка металла (металлический электрод), то при соединении электродов металлическим проводником, по нему потечет электрический ток. Возникнет гальванический элемент – устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в энергию электрического тока. ЭДС (электродвижущая сила) гальванического элемента e равна разности равновесных потенциалов электродов: e = jRed – jOx, где jRed – потенциал катода (электрода, на котором идут процессы восстановления); jOx – потенциал анода (электрода, на котором идут процессы окисления). ЭДС гальванического элемента можно измерить. За стандартный потенциал j0 данного металлического электрода принимается ЭДС гальванического элемента, составленного из стандартного водородного электрода и пластинки металла, помещенной в раствор соли этого металла, причем активность (в разбавленных растворах можно использовать концентрацию) катионов металла в растворе должна бать равна 1 моль/л; Т=298 К; р=1 атм. (стандартные условия). Значение стандартного электродного потенциала всегда относят к полуреакции восстановления Men++ne- = Me. Располагая металлы в порядке возрастания величины их стандартных электродных потенциалов j0, отвечающих полуреакции восстановления, получают ряд напряжений металлов (ряд стандартных электродных потенциалов). В этот же ряд помещают стандартный электродный потенциал водородного электрода, принимаемый за нуль. Далее, в таблице 13.1, приводится ряд напряжений для наиболее распространенных металлов:
Таблица 13.1 – Стандартные электродные потенциалы металлических электродов
Этот ряд характеризует окислительно-восстановительную способность системы «металл – ион металла» в водных растворах при стандартных условиях. Чем левее в ряду напряжений стоит металл (чем меньше его j0), тем более сильным восстановителем он является, и тем легче атомы металла отдают электроны, превращаясь в катионы, но катионы этого металла труднее присоединяют электроны, превращаясь в нейтральные атомы. Окислительно-восстановительные реакции с участием металлов и их катионов идут в том направлении, при котором металл с меньшим электродным потенциалом является восстановителем, то есть окисляется, а катионы металла с большим электродным потенциалом – окислителями, то есть восстанавливаются. Поэтому металлы, стоящие в ряду напряжений левее, вытесняют металлы, стоящие правее, из растворов их солей. Металлы, стоящие в ряду напряжений левее водорода, могут восстанавливать его из кислот, являющихся окислителями только по иону водорода (водные растворы галогеноводородов, ортофосфорная кислота, муравьиная (НСООН), уксусная (СН3СООН), разбавленные водные растворы H2SO4, HСlO4 и другие). Металлы, стоящие правее водорода, из этих кислот в обычных условиях водород не вытесняют. Однако не все кислоты взаимодействуют с металлами с образованием водорода. Это отражено в таблице 13.2. Для того чтобы правильно определить направление протекания реакции в случаях, когда стандартные электродные потенциалы металлов близки по величине, а условия реакции отличны от стандартных, нужно учитывать зависимость электродных потенциалов от концентраций (точнее активностей) участников реакции и температуры. Зависимость электродных потенциалов от концентрации выражается уравнением Нернста, которое применительно к системе Men++ne-=Me запишется в виде:
где R – газовая постоянная; F – постоянная Фарадея (»96500 Кл/моль); n – число электронов, участвующих в процессе; аМеn+ - активность ионов металла в растворе. Принимая Т=298К, получим:
причем активность в разбавленных растворах можно заменить концентрацией ионов, выраженной в моль/л. Таблица 13.2 – Взаимодействие металлов с кислотами
13.1.2 Коррозия металлов
Коррозия металлов – это самопроизвольный процесс разрушения металлов и металлических изделий в результате окисления веществами окружающей среды В зависимости от механизма протекания коррозия подразделяется на химическую и электрохимическую. Возможна также биологическая коррозия в результате воздействия микроорганизмов. Химическая коррозия характерна для сред, не проводящих электрический ток. По условиям протекания подразделяется на газовую коррозию и коррозию в неэлектролитах. Электрохимическая коррозия возникает при взаимодействии металлов с растворами и расплавами электролитов, электропроводящими органическими жидкостями. Именно этот вид коррозии наносит наибольший урон. Поверхность металла практически всегда структурно и термодинамически неоднородна: примеси других металлов и соединений, неоднородность внутренних напряжений, искажения решетки металла, выход на поверхность ребер и граней кристаллов, обладающих избыточной энергией и др. Если энергетически неоднородные участки поверхности металла покрыты электролитом, то они приобретают различные потенциалы и образуют микрогальванические пары. В этом случае электрохимическая коррозия будет протекать по механизму действия гальванического элемента. Отличие состоит лишь в том, что отсутствует внешняя цепь, а электроны движутся внутри самого металла. В качестве примера рассмотрим атмосферную коррозию железа, если в нем имеются примеси меди – менее активного металла, обладающего более высоким значением стандартного электродного потенциала по сравнению с железом. При повышенной влажности поверхность металла покрыта тонкой пленкой воды, в которой растворены соли, атмосферный кислород, углекислый газ, оксиды серы, азота и другие атмосферные примеси. Такая пленка представляет собой раствор электролита. В подобной среде на железе, содержащем примеси меди, образуются микрогальванические пары. Через толщу металла электроны будут переходить от железа, потенциал которого меньше, к меди, потенциал которой больше. На меди возникнет избыток электронов, за счет этого на ней будут протекать процессы восстановления. Медь выполняет функции катода. Анодом будет являться железо, на нем будут идти процессы окисления. Анодный процесс на железе: Fe0 – 2e - =Fe2+ Железо окисляется. Железное изделие разрушается. Катодные процессы на меди: Наиболее часто наблюдается восстановление растворенного в воде кислорода и катионов водорода, сама медь не подвергается изменениям: а) О2 + 2Н2О + 4е - = 4ОН – - в нейтральной или щелочной среде; б) О2 + 4 Н+ + 4е - =2Н2О - в кислой среде; в) 2Н+ + 2е - =Н2 - в кислой или нейтральной среде. Первые два уравнения отвечают коррозии с кислородной деполяризацией, третье – коррозии с водородной деполяризацией. В результате коррозии железа образуется ржавчина – гидратированные формы оксида железа с переменным содержанием воды: FexOy× n H2O. Коррозия с водородной деполяризацией, если она термодинамически возможна, протекает в кислых растворах с большей скоростью, чем коррозия с кислородной деполяризацией. В общем случае с увеличением концентрации водородных ионов скорость коррозии с водородной деполяризацией увеличивается, так как в соответствии с уравнением Нернста, увеличивается потенциал системы 2Н+ + 2е - =Н2. Однако концентрированная кислота может пассивировать металл. Пассивация, в основном, вызывается образованием на поверхности металла оксидных или иных защитных слоев, предохраняющих металл от дальнейшей коррозии. Так веду себя Al; Cr; Ni; Fe и некоторые другие металлы в концентрированных серной и азотной кислотах. На основе понимания механизма электрохимической коррозии разработаны разнообразные способы борьбы с ней. Перечислим их. ˗ Легирование – введение в состав сплава компонентов, повышающих устойчивость металлов к коррозии. Например, в качестве легирующих добавок к железу применяют никель и хром (нержавеющая сталь). ˗ Защита поверхности металла покрытиями, которые бывают нескольких видов: а) неметаллические (лаки, краски, эмали); б) покрытия, образующиеся в результате химической обработки поверхности металла (например, воронение стали); в) металлические покрытия, которые подразделяются на анодные (покрытие более активным металлом, образующим устойчивые к коррозии оксидные пленки) и катодные (покрытие менее активным металлом). При повреждении анодного покрытия будет анодно растворяться само покрытие, а не основной металл. При повреждении катодного покрытия растворяется основной металл, а не металл покрытия. ˗ Введение в коррозионную среду ингибиторов (замедлителей) коррозии. ˗ Электрохимическая защита, которая применяется в средах с хорошей ионной проводимостью, например, морская вода, почва. К электрохимической защите относится протекторная, катодная и анодная защита. Протекторная защита – это присоединение к защищаемому изделию большого листа из более активного металла, который выступает в качестве анода и окисляется, материал изделия выступает в роли катода, он защищен от коррозии. При катодной защите защищаемая деталь присоединяется к отрицательному полюсу внешнего источника тока и становится катодом. В качестве анода используются куски железа, которые присоединяются к положительному полюсу источника тока, при этом подвергаясь анодному окислению. При анодной защите защищаемое изделие подключается к положительному полюсу внешнего источника тока, при этом происходит пассивация защищаемого металла.
13.2 Методика проведения опытов
13.2.1 Опыт №1. Взаимодействие металлов с соляной кислотой В четыре пробирки налить по 2 – 3 мл соляной кислоты и поместить в них по кусочку алюминия, цинка, железа и меди порознь. Какие из взятых металлов вытесняют водород из кислоты? Написать уравнения реакций. 13.2.2 Опыт №2. Взаимодействие металлов с серной кислотой В пробирку опустить кусочек железа и добавить 1 мл 2н. серной кислоты. Что наблюдается? Повторить опыт с кусочком меди. Протекает ли реакция? Проверить действие концентрированной серной кислоты на железо и медь. Объяснить наблюдения. Написать все уравнения реакций.
13.2.3 Опыт №3. Взаимодействие меди с азотной кислотой Положить в две пробирки по кусочку меди. В одну из них налить 2 мл разбавленной азотной кислоты, во вторую – концентрированной. При необходимости содержимое пробирок подогреть на спиртовке. Какой газ образуется в первой пробирке, а какой во второй? Записать уравнения реакций.
13.2.4 Опыт №4. Взаимодействие металлов с солями Налить в пробирку 2 – 3 мл раствора сульфата меди (II) и опустить кусочек железной проволоки. Что происходит? Повторить опыт, заменив железную проволоку кусочком цинка. Написать уравнения реакций. Налить в пробирку 2 мл раствора ацетата или нитрата свинца (II) и опустить кусочек цинка. Что происходит? Написать уравнение реакции. Указать окислитель и восстановитель. Будет ли протекать реакция, если цинк заменить медью? Дать объяснение.
13.2.5 Опыт №5. Пассивация алюминия В пробирку поместить кусочек алюминия и прилить 2 – 3 мл концентрированной азотной кислоты. Через 3 – 4 минуты кислоту слить, промыть металл водой и подействовать на него 2н. раствором соляной кислоты. Почему теперь алюминий не растворяется в соляной кислоте?
13.2.6 Опыт №6. Коррозия железа при контакте с цинком и оловом В железную скрепку для бумаги вставить кусочек цинка, в другую Какую окраску приобретает жидкость в пробирке, в которой находится скрепка с оловом? Какие ионы появились в растворе? На что это указывает? Наблюдается ли окрашивание раствора в другой пробирке? Разобрать протекающие процессы, исходя из величин стандартных электродных потенциалов железа, цинка и олова. Записать схемы коррозии оцинкованного и луженого железа, указав катодные и анодные процессы. Выводы оформить в виде таблицы 13.3. Таблица 13.3 – Выводы из опыта №6
13.3 Примеры решения задач
Пример 1 Будет ли протекать химическая реакция: а) при погружении цинка в раствор нитрата серебра, б) при погружении серебра в раствор хлорида магния? Решение а) Для выяснения возможности протекания окислительно-восстановительной реакции выпишем из справочника физико-химических величин стандартные электродные потенциалы систем, указанных в примере: Ag++ e - =Ag j0Ag=0,80 В Zn2++ 2e - =Zn j0Zn= -0,76 B Поскольку j0Ag значительно превышает по величине j0Zn,то цинк будет окисляться, образуя катионы Zn2+, а ионы серебра будут восстанавливаться, превращаясь в нейтральные атомы. В результате протекает химическая реакция в соответствии с уравнением 2AgNO3 + Zn = 2Ag + Zn(NO3)2. б) При погружении серебра в раствор хлорида магния серебро не будет вытеснять магний из его соли, так как j0Ag больше j0Mg (серебро стоит в ряду напряжений правее магния). Серебро не может выступать в роли восстановителя (окисляться), вот почему химическая реакция между серебром и хлоридом магния не протекает. Пример 2 Стандартные электродные потенциалы олова и свинцы равны -0,14 В и Решение Так как стандартные электродные потенциалы олова и свинца близки по величине, то для ответа на вопрос задачи необходимо рассчитать электродные потенциалы систем Pb2+ + 2e - =Pb и Sn2+ + 2e - =Sn в условиях, отличных от стандартных. Для этого воспользуемся уравнением Нернста:
jSn = -0,14 + 0,059 : 2 ×lg0,1 = -0,17 В; jZn = -0,13 + 0,059 : 2 ×lg0,001 = -0,22 В. Так как потенциал олова в данных условиях больше потенциала свинца, то олово не может выступать в качестве восстановителя, оно не будет вытеснять свинец из раствора его соли.
13.4 Требования к уровню подготовки студентов
˗ Иметь представление о причинах возникновения двойного электрического слоя на границе «металл – водный раствор его соли». ˗ Знать понятие стандартного электродного потенциала, иметь представление о его измерении. ˗ Знать, что такое ряд напряжений металлов, что он характеризует. ˗ Уметь использовать ряд напряжений металлов для определения направления окислительно-восстановительных реакций с участием металлов и их катионов, а также металлов и кислот. ˗ Уметь использовать уравнение Нернста для определения электродного потенциала в условиях, отличных от стандартных. ˗ Знать, что называется коррозией металлов, какие существуют ее виды, в чем их отличие. ˗ Знать причины возникновения коррозионных микрогальванических элементов, что такое коррозия с водородной и кислородной деполяризацией. ˗ Уметь составлять уравнения анодных и катодных процессов, протекающих при электрохимической коррозии. ˗ Иметь представление о методах защиты металлов от коррозии.
13.5 Задания для самоконтроля
13.5.1 Железные пластинки погружены в водные растворы следующих веществ:KBr; Pb(NO3)2; MgSO4; HCl; AgNO3; ZnCl2; H2SO4(конц.); H3PO4; SnSO4. С какими веществами будет реагировать железо? Записать уравнения реакций. Какие реакции будут протекать, если заменить железные пластинки медными? 13.5.2 Никелевая и кобальтовая пластинки помещены в водный раствор смеси солей: хлорида кобальта концентрацией 1 моль/л и хлорида никеля концентрацией 10 – 3 моль/л. Возможно ли выделение кобальта на никелевой пластинке, если стандартные электродные потенциалы равны: Ni2+ + 2e - =Ni; j0= -0,23 В Co2+ + 2e - =Co; j0= -0,28 В. 13.5.3 Приведите примеры катодных и анодных покрытий для железа. Запишите для этих примеров уравнения процессов, протекающих на катоде и на аноде а) во влажном воздухе, б) в кислой среде при нарушении целостности покрытий. 13.5.4 Медь не вытесняет водород из разбавленной соляной кислоты. Однако, если к медной пластинке, опущенной в эту кислоту, прикоснуться цинковой проволокой, то на меди начинается выделение водорода. Объясните причину этого явления, записав уравнения катодного и анодного процессов. 13.5.5 Какой из перечисленных металлов: а) Cu; б) Mg; в) Ni; г) Pb – может служить в качестве протектора для железной конструкции? 13.5.6 Какой из перечисленных металлов: а) Au; б) Zn; в) Ag; г) Pb – может служить анодным покрытием для кобальта? 13.5.7 Какой из перечисленных металлов: а) Сu; б) Cr; в) Mn; г) Mg – может служить катодным покрытием для кобальта? 13.5.8 Какие из перечисленных металлов: а) Hg; б) Sn; в) Zn; г) Fe – не могут вытеснять H2 из раствора HCl? 13.5.9 Какие из перечисленных металлов: а) Sn; б) Bi; в) Fe; г) Cr – не могут вытеснять Н2 из разбавленной H2SO4? 13.5.10 Какие из перечисленных металлов: а) Sb; б) Cu; в) Fe; г) Bi – могут вытеснять Sn из раствора SnSO4? 13.5.11 Какова величина электродного потенциала Mg в 0,1 М растворе MgCl2 при 25 0С, если стандартный электродный потенциал равен -2,363 В? 13.5.12 Какова величина электродного потенциала Zn в 0,001 М растворе ZnCl2 при 25 0С, если стандартный электродный потенциал равен -0,763 В? 13.5.13 Какова величина электродного потенциала Ag в 0,001 М растворе AgNO3 при 25 0С, если стандартный электродный потенциал равен 0,799 В? 13.5.14 Какова величина электродного потенциала Fe в 0,01 М растворе FeCl3 при 25 0С, если стандартный электродный потенциал равен -0,036 В?
13.6 Список рекомендуемой литературы
13.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с. 13.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с. 13.6.3 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 2008. – 240 с. 14 Лабораторная работа №16 Жесткость воды, методы ее определения
Цель работы: познакомиться с понятием жесткости воды; овладеть методиками определения общей, временной (карбонатной) и постоянной (некарбонатной) жесткости воды методами потенциометрического и кислотно-основного титрования.
Оборудование и реактивы: 0,1н. соляная кислота; 0,1н. раствор трилона Б; индикаторы: эриохром черный кристаллический, фенолфталеин, метиловый оранжевый; аммиачный буфер; рН-метр; магнитная мешалка; бюретки; пипетки на 100 мл или мерные цилиндры; колбы на 250 мл и 500 мл; стаканы на 200 – 250 мл; мерные колбы на 200 мл; бумажные фильтры.
14.1 Теоретические пояснения
Природная вода в своем составе всегда содержит различные примеси: соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие образования. Некоторые соли, присутствующие в воде, вызывают ее жесткость. Жесткость воды – это совокупность свойств воды, обусловленных присутствием в ней катионов Ca2+ и Mg2+, реже Fe2+. Содержание в воде большого количества примесей растворимых солей кальция и магния делает ее непригодной для технических целей. Повышенная жесткость воды приводит к образованию накипи в паровых котлах и бытовой посуде. Это ухудшает теплообмен, а, следовательно, приводит к перерасходу топлива, электроэнергии, перегреву металлических поверхностей. В жесткой воде ухудшается пенообразование и увеличивается расход мыла при стирке, так как часть содержащихся в нем растворимых солей жирных кислот переходит в нерастворимое состояние: 2C17H35COONa + CaSO4 = (C17H35COO)2Ca¯ + Na2SO4. При этом также ухудшается качество тканей вследствие осаждения на них нерастворимых кальциевых и магниевых солей высших жирных кислот. В воде с повышенной жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками нерастворимые соединения. Большая магниевая жесткость придает воде горький вкус. Суммарное содержание Ca2+ и Mg2+ в воде называется общей жесткостью. Жесткость воды оценивается по-разному. В нашей стране ее чаще всего выражают количеством вещества эквивалентов кальция и магния (в ммоль) в одном литре воды. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв./л. По величине жесткости воду условно подразделяют на мягкую (до 4 ммоль экв./л), средней жесткости (4 – 8 ммоль экв./л), жесткую (8 – 12 ммоль экв./л) и очень жесткую (более 12 ммоль экв./л). Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов кальция, магния, а иногда также и гидрокарбоната Ca(HCO3)2 Mg(HCO3)2 2MgCO3 + H2O (MgOH)2CO3+H2O Fe(HCO3)2 4Fe(OH)2 + O2 + 2 H2O ® 4Fe(OH)3. При кипячении воды растворенные в ней гидрокарбонаты разлагаются, и карбонатная жесткость сильно снижается, однако полного устранения карбонатной жесткости не происходит вследствие того, что карбонаты кальция и магния несколько растворим в воде. Наряду с понятием карбонатная жесткость, используется термин устранимая жесткость. Это та величина, на которую понижается жесткость при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью. Для уменьшения карбонатной жесткости применяют также метод известкования: Ca(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O Mg(HCO3)2 + 2Ca(OH)2 ® Mg(OH)2¯ + 2CaCO3¯ + 2H2O. Некарбонатная жесткость обусловлена присутствием в воде растворимых, устойчивых к нагреванию солей кальция и магния. Чаще всего это сульфаты и хлориды. Некарбонатную жесткость можно устранить обработкой воды карбонатом или фосфатом натрия: MeSO4 + Na2CO3 ® MeCO3¯ + Na2SO4. Для устранения жесткости применяют также катиониты. Это ионообменные смолы и алюмосиликаты, содержащие в своем составе подвижные катионы, например, Na+, H+, способные обмениваться на катионы среды. Если пропускать воду через слои катионита, то его подвижные катионы будут обмениваться на катионы кальция и магния, при этом катионы жесткости остаются в катионите, а подвижные ионы катионита переходят в раствор. При помощи Для умягчения воды можно также использовать и физические методы: электродиализ, ультразвуковую, магнитную и магнитно-ионизационную обработку воды. Жесткость воды определяется аналитически. Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой при этом протекают реакции: Са(НСО3)2 + 2НС1 = CaCI2 + 2H2O + 2СO2 Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2 Титрование – это постепенное прибавление к анализируемому раствору раствора реагента точно известной концентрации (титрованный или стандартный раствор, называемый также рабочим раствором или титрантом) в количестве, эквивалентном содержанию определяемого вещества в анализируемом растворе. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности. Титрование жесткой воды соляной кислотой будет сопровождаться изменением рН, поэтому точку эквивалентности можно определить либо потенциометрическим титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН), либо титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового оранжевого). Зависимость рН титруемого раствора от объема прилитого титранта можно выразить при помощи интегральных кривых титрования. Они могут быть получены либо в результате теоретических расчетов, либо в результате экспериментальных измерений рН при помощи прибора рН-метра. В качестве примера, на рисунке 14.1 приводится интегральная кривая титрования сильной кислоты сильным основанием.
Рисунок 14.1 – Кривая титрования 0,1н. раствора HCl 0,1н. раствором NaOH Если титруется 10 мл раствора, то 1% избытка кислоты или щелочи соответствует 0,1 мл. Принимая это во внимание, из рисунка 14.1 следует, что вблизи точки эквивалентности последняя капля титранта вызывает резкое изменение рН. Этот момент в титровании получил название скачка титрования, ему соответствует почти вертикальный участок на кривой титрования сильной кислоты сильным основанием. За ходом титрования удобно наблюдать визуально по изменению окраски кислотно-основных индикаторов. Это вещества (чаще всего слабые органические кислоты или основания), у которых при изменении рН среды изменяется окраска. Интервал значений рН, в котором индикатор изменяет свою окраску, называется интервалом перехода индикатора. Для различных индикаторов он различен, так как зависит от константы диссоциации индикатора, а она определяется природой вещества и для различных индикаторов различна. Для выбора соответствующего кислотно-основного индикатора необходимо построить интегральную кривую титрования на основании данных потенциометрического титрования, а затем выбрать такой индикатор, интервал перехода окраски которого попадает в область скачка рН на кривой титрования. В таблице 14.1 приводятся интервалы перехода окраски для некоторых индикаторов.
Таблица 14.1 – Характеристики наиболее часто применяемых кислотно-основных индикаторов
Некарбонатную (постоянную) жесткость воды определяют методом обратного титрования. К отмеренному объему исследуемой воды добавляют определенный объем раствора карбоната натрия известной концентрации и выпаривают раствор досуха. При этом образуются нерастворимые в воде карбонаты кальция и магния. Са2+ + Mg2+ + 2Na2CO3 = CaCO3¯ + MgCO3¯ + 2Na+ Сухой остаток, представляющий из себя смесь карбонатов кальция, магния, натрия и других солей натрия, растворяют в не содержащей СО2 воде, отфильтровывают нерастворимые в воде карбонаты кальция и магния и титриметрическим способом определяют в растворе количество избыточного Na2CO3, не вошедшего в реакцию осаждения карбонатов. Специальными опытами показано, что при этом Na2CO3 не реагирует с гидрокарбонатами кальция и магния. Именно поэтому, рассмотренный метод позволяет определять постоянную жесткость воды. Современным методом определения общей жесткости воды является титрование воды раствором трилона Б в присутствии специальных Трилон Б (комплексон III) – это динатриевая соль этилендиамминтетрауксусной кислоты (NaO2CCH2)2N(CH2)2N(CH2CO2H)2, сокращенно – Na2H2ЭДТА. Na2H2ЭДТА + Са2+ (или Mg2+) ® Na2CaЭДТА + 2H+. Хромоген образует с ионами магния и другими ионами относительно непрочные комплексные соединения, окрашенные в красно-фиолетовый цвет. При титровании трилоном Б содержащиеся в воде ионы Са2+ и Mg2+, а также ионы Cu2+, Zn2+, Mn2+, Cd2+, Ni2+, Al3+, Fе2+, Fe3+ реагируют с ним и образуют мало диссоциированные бесцветные прочные комплексные соединения. В конце титрования ионы магния, кальция и другие переходят от комплексного соединения с хромогеном к трилону Б, с образованием прочных бесцветных комплексов. Поэтому в точке эквивалентности красно-фиолетовая окраска раствора исчезает. Однако раствор не обесцвечивается, а окрашивается в сине-фиолетовый цвет – цвет самого хромогена эриохрома черного при рН = 9-10 (аммиачный буфер). Это указывает на окончание титрования. Так как трилон Б образует прочные комплексы со всеми катионами кальция и магния вне зависимости от характера аниона, то комплексонометрическим методом определяют именно общую жесткость воды. Проба воды должна характеризовать действительный ее состав, поэтому при отборе пробы из водопровода воду спускают в течение 10-15 минут. Когда склянка наполнится, воду некоторое время переливают через край. Из рек и ручьев отбирают пробы воды на глубине 0,75 м в нескольких местах, около берегов и в середине реки. Отдельные пробы смешивают вместе. Анализ воды проводят сразу же после взятия пробы или, в крайнем случае, при соответствующем хранении спустя несколько часов. 14.2 Методика проведения опытов
14.2.1 Опыт №1. Определение карбонатной жесткости воды Мерным цилиндром отбирают в две конические колбы по 100 мл исследуемой воды из-под крана. Оттитровывают воду в первой колбе 0,1н. раствором НСl. Для этого с помощью рН-метра фиксируют значения рН воды после каждого прибавления очередной порции HCl из бюретки. Объем каждой порции HCl составляет 0,5 мл. По полученным данным строят интегральную кривую титрования (график зависимости рН от объема прилитой кислоты, в мл). По кривой титрования определяют точку эквивалентности. Пользуясь данными таблицы 14.1 выбирают индикатор для экспресс-анализа. Интервал перехода окраски выбранного индикатора должен находиться в пределах скачка рН на интегральной кривой титрования. Карбонатную жесткость воды Жкарб., выраженную в ммоль экв./л, определяют по формуле (14.1):
где V(HCl) – объем раствора 0,1н. НСl, израсходованного до достижения точки эквивалентности, мл; С(HCl) – концентрация раствора HCl, моль экв./л; V(Н2О) – объем исследуемой воды, мл; 1000 – коэффициент пересчета от моль к ммоль. Затем проводят титрование воды во второй колбе 0,1н. раствором НСl. Только на этот раз за ходом титрования следят визуально, по изменению окраски выбранного индикатора. Вблизи точки эквивалентности последняя капля титранта вызывает резкое изменение окраски раствора, содержащего индикатор. Фиксируют объем прибавленной кислоты к моменту достижения точки эквивалентности. Проводят расчет карбонатной жесткости воды по формуле (14.1).
14.2.2 Опыт №2. Определение общей жесткости воды В коническую колбу отмеряют пипеткой 100 – 150 мл исследуемой воды, добавляют 5 мл аммиачного буфера и несколько кристаллов эриохрома черного до образования заметной вишнево-красной окраски. При слабой окраске раствора проверяют его рН универсальной индикаторной бумагой. Значение рН должно находиться в интервале 8-11. При необходимости корректируют рН добавлением в раствор буферной смеси. Раствор оттитровывают стандартным раствором трилона Б до точки резкого перехода вишнево-красной окраски в синюю. Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б прибавляют осторожно, по каплям, энергично перемешивая. Титрование повторить два раза и взять среднее значение объема израсходованного раствора трилона Б. Общую жесткость воды Жобщ., выраженную в ммоль экв./л, определяют по формуле (14.2):
где V1 – объем рабочего раствора трилона Б, израсходованного на титрование пробы воды, мл; N – молярная концентрация эквивалента рабочего раствора трилона Б, V2 – объем исследуемой воды, мл; 1000 – коэффициент пересчета от моль к ммоль. По разности значений общей и карбонатной жёсткости определить постоянную жесткость. Сделать вывод о характере и степени жесткости исследуемой воды.
14.3 Примеры решения задач
Пример 1 Рассчитайте общую жесткость воды (ммоль экв./л), если в 0,15 л воды содержится 16,2 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния. Решение Выразим общую жесткость воды как сумму миллимолярных концентраций эквивалентов двухзарядных катионов металлов (или соответствующих им солей) в воде:
где m1, m2, mi – массы двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, мг; M1, M2, Mi – молярные массы эквивалентов двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, г/моль; V – объем воды, л. Молярные массы эквивалентов солей, перечисленных в условии задачи, рассчитываются по формуле:
где z – эквивалентное число, для солей жесткости оно равно 2;
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости:
=2,56 ммоль экв./л
Пример 2 Определите временную жесткость воды, если на титрование 0,1 л воды, содержащей гидрокарбонат магния, израсходовано 7,2∙10-3 л 0,14н. раствора HCl. Решение При титровании воды соляной кислотой происходит реакция: Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2 Временную жесткость воды рассчитаем по формуле (8.1):
Пример 3 Для устранения общей жесткости по известково-содовому методу добавлено 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитать временную и постоянную жесткость воды. Решение Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции: Ca(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O Mg(HCO3)2 + 2Ca(OH)2 ® Mg(OH)2¯ + 2CaCO3¯ + 2H2O. Ca(NО3)2 + Na2CO3 = MeCO3¯ + 2NaNO3 Mg(NО3)2 + Na2CO3 = MeCO3¯ + 2NaNO3 Временную жесткость воды Жвр измеряют количеством вещества эквивалентов гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост – количеством вещества эквивалентов карбоната натрия. M(1/2Са(ОН)2) = 74/2=37 г/моль; M(1/2Na2CO3) = 106/2=53 г/моль;
Общая жесткость воды равна: Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль экв./л 14.4 Требования к уровню подготовки студентов
˗ Знать понятия: общая, временная (карбонатная) и постоянная (некарбонатная) жесткость воды. ˗ Понимать для чего необходимо умягчение воды. ˗ Иметь представление об аналитических методах определения различных видов жесткости. ˗ Уметь производить расчеты жесткости воды, а также расчеты количеств реактивов, необходимых для ее устранения.
14.5 Задания для самоконтроля
14.5.1 При определении карбонатной жесткости воды используют индикатор метиловый оранжевый. Почему нельзя использовать фенолфталеин? 14.5.2 Почему при кипячении воды ее временная (устранимая) жесткость уменьшается? 14.5.3 Почему комплексонометрическим методом определяют только общую жесткость? 14.5.4 Какие соли вызывают постоянную жесткость? Почему она так называется? 14.5.5 Что происходит при кипячении жесткой воды с гидроксидом натрия? Почему израсходованное количество NaOH эквивалентно суммарному количеству растворенных солей некарбонатного происхождения? 14.5.6 Что такое обратное титрование и как его осуществляют? Какие преимущества имеет этот метод? 14.5.7 Какой вид жесткости воды определяют при помощи титрования раствором кислоты? Какая реакция при этом происходит? 14.5.8 Какая характеристика раствора изменяется при кислотно-основном титровании? Какими методами можно фиксировать точку эквивалентности? 14.5.9 Благодаря каким свойствам трилон Б (комплексон III) можно использовать в качестве титранта при определении общей жесткости воды? 14.5.10 Для чего используется аммиачный буферный раствор при определении общей жесткости? 14.5.11 Почему при определении общей жесткости воды прибавление кристаллов эриохрома черного вызывает покраснение раствора, а в точке эквивалентности раствор синеет? 14.5.12 На титрование 100 мл воды пошло 2 мл 0,1н. раствора трилона Б. Рассчитайте жесткость воды. 14.5.13 Вода содержит в 10 л 0,95 г хлорида магния и 1,62 г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды. 14.5.14 Чему равна жесткость воды, выраженная в ммоль экв./л, если концентрация СаCl2 составляет 0,005 моль/л? 14.5.15 Растворимость СаSO4 в воде 0,202%. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл. 14.5.16 Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость образца воды в ммоль экв./л? 14.5.17 На титрование 0,05 л образца воды израсходовано 4,8∙10-3 л 0,1н. раствора HCl. Чему равна карбонатная жесткость воды? 14.5.18 Какую массу гашеной извести надо прибавить к 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль экв./л? 14.5.19 При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25∙10-3 л 0,101н. раствора HCl. Какова величина жесткость этой воды? 14.5.20 Образец воды объемом 1 литр содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды? 14.5.21 Некарбонатная жесткость воды равна 3,18 ммоль экв./л. Какую массу Na3РO4 надо взять, чтобы умягчить 1м3 воды?
14.6 Список рекомендуемой литературы
14.6.1 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с. 14.6.2 Васильев В.П. Аналитическая химия. В 2 кн. Кн. 1: Титриметрические и гравиметрический методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. – М.: Дрофа, 2009. – 368 с. 14.6.3 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – С.146 – 149.
Лабораторная работа №15. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 215. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 , (13.1)
, (13.1) – стандартный электродный потенциал;
– стандартный электродный потенциал; , (13.2)
, (13.2)
 H2
H2
 H2S; S; SO2
H2S; S; SO2  SO2
Чем более активен металл и более концентрирована кислота, тем глубже происходит восстановление серы в кислоте.
SO2
Чем более активен металл и более концентрирована кислота, тем глубже происходит восстановление серы в кислоте.


 NH4+; N2 (t0C); N2O N2O; NO NO
Чем более активен металл и более разбавлена кислота, тем глубже происходит восстановление азота в кислоте, в очень разбавленных растворах с активными металлами возможно частичное выделение водорода
NH4+; N2 (t0C); N2O N2O; NO NO
Чем более активен металл и более разбавлена кислота, тем глубже происходит восстановление азота в кислоте, в очень разбавленных растворах с активными металлами возможно частичное выделение водорода

 NO NO2
NO NO2
 CaCO3¯ + H2O + CO2
CaCO3¯ + H2O + CO2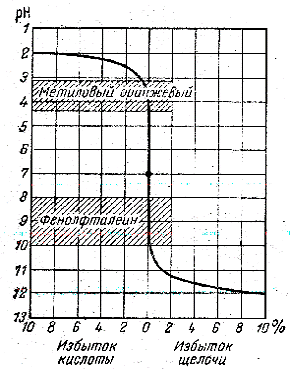
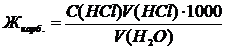 , (14.1)
, (14.1) , (14.2)
, (14.2) ,
, ,
,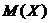 – молярная масса соли Х.
– молярная масса соли Х.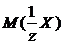 , г/моль
, г/моль
 =
= =10,08 ммоль экв./л
=10,08 ммоль экв./л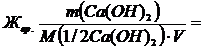 7400/(37∙50) = 4 ммоль экв./л;
7400/(37∙50) = 4 ммоль экв./л; 5300/(53∙50) = 2 ммоль экв./л
5300/(53∙50) = 2 ммоль экв./л