
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Как повлияет на равновесие реакции2SO2+O2⇄ 2SO3; DH= - 172,38 кДж а) увеличение концентрации SO2, б) повышение давления в системе, в) охлаждение системы, г) введение в систему катализатора? Решение В соответствии с принципом Ле Шателье при увеличении концентрации SO2 равновесие сместится в сторону процесса, приводящего к расходованию SO2, то есть в сторону прямой реакции образования SO3. Реакция идет с изменением числа моль газообразных веществ, поэтому изменение давления приведет к смещению равновесия. При повышении давления равновесие сместится в сторону процесса, противодействующего данному изменению, то есть идущего с уменьшением числа моль газообразных веществ, а, следовательно, и с уменьшением давления. В соответствии с уравнением реакции, число моль газообразных исходных веществ равно трем, а число моль продуктов прямой реакции равно двум. Поэтому при повышении давления равновесие сместится в сторону прямой реакции образования SO3. Так как DН< 0, то прямая реакция идет с выделением тепла (экзотермическая реакция). Обратная реакция будет протекать с поглощением тепла (эндотермическая реакция). В соответствии с принципом Ле Шателье, охлаждение вызовет смещение равновесия в сторону реакции, идущей с выделением тепла, то есть в сторону прямой реакции. Введение в систему катализатора не вызывает смещения химического равновесия.
Пример 2 Вычислить константу равновесия реакции FeO(к)+H2(г) ⇄ Fe(к)+H2O(г) при 250С. В какую сторону смещено равновесие? Определить температуру установления равновесия, если все вещества находятся в стандартных состояниях, а зависимостью DH0 и DS0 от температуры можно пренебречь.  Решение Константа равновесия связана с изменением стандартной энергии Гиббса реакции уравнением
Воспользовавшись справочными значениями стандартных энергий Гиббса образования веществ, найдем DG0р-ции:
DG0р-ции=DG0(H2O(г))+ DG0(Fe(к))- DG0(FeO(к))- DG0(H2(г))= = - 228,61 (кДж/моль) + 0 – (-244,3 (кДж/моль)) – 0 = 15,59 кДж = 15,59 × 103 Дж К= Константа равновесия меньше единицы, следовательно, равновесие при 250С (298 К) смещено в сторону обратной реакции. В состоянии равновесия DG0= 0. Так как DG0= DН0 - TDS0, то равновесие установится при температуре T=DН0 / DS0. Воспользовавшись справочными значениями стандартных энтальпий образования веществ и их стандартных энтропий, вычислим значения DН0р-ции и DS0р-ции: DН0р-ции=DН0(Н2О(г)) +DН0(Fe(к)) - DН0(FeO(к)) - DН0(Н2(г)) = = - 241,82 (кДж/моль) + 0 – (- 263,7 (кДж/моль)) – 0 = 21,88 кДж. DS0р-ции=S0(Н2О(г)) + S0(Fe(к)) - S0(FeO(к)) - S0(Н2(г)) = =0,1887( кДж/моль× К) + 0,02715( кДж/моль× К) – 0,05879 (кДж/моль× К) – - 0,13058 (кДж/моль× К) = 0,02648 кДж/К. Найдем значение температуры, при которой установится равновесие: Т = 21,88( кДж) : 0,02648( кДж/К) = 826 К. Пример 3 При температуре 973 К константа равновесия реакции NiO + H2⇄ Ni + H2O(г) равна 0,32. Рассчитать равновесные концентрации веществ газовой смеси, если начальная концентрация водорода равна 3 моль/л. Решение Считаем, что начальная концентрация паров воды равнялась нулю. Выражение для константы равновесия данной гетерогенной реакции имеет следующий вид: КС=[Н2О] / [Н2]. Пусть к моменту равновесия концентрация паров воды стала равна х моль/л. Тогда в соответствии со стехиометрией реакции, концентрация водорода уменьшилась на х моль/л и стала равной (3 – х) моль/л. Подставим равновесные концентрации в выражение для константы равновесия: КС=х / (3 – х); х / (3 – х)=0,32; х=0,73 моль/л. Итак, равновесная концентрация паров воды равна 0,73 моль/л, равновесная концентрация водорода равна 3 – 0,73 = 2,27 моль/л.
6.4 Требования к уровню подготовки студентов
˗ Знать понятия: химическое равновесие, константа химического равновесия. ˗ Знать признаки химического равновесия, взаимосвязь между константой равновесия и энергией Гиббса, принцип Ле Шателье, как влияют изменения концентрации реагентов, температуры, давления на состояние равновесия. ˗ Уметь записывать выражение для константы равновесия гомогенной и гетерогенной реакции, вычислять значение константы равновесия по значениям равновесных концентраций реагентов, определять направление смещения химического равновесия, используя принцип Ле Шателье, вычислять значение DG0 по значению константы равновесия и наоборот, оценивать по величинам DG0 и К глубину протекания процесса в данном направлении, рассчитывать температуру равновесного состояния системы по уравнению DG= DН - TDS. 6.5 Задания для самоконтроля
6.5.1 Записать выражения для констант равновесия следующих реакций: CaCO3⇄ CaO + CO2 FeO + H2⇄ Fe + H2O(пар) BaSO4(кр.) ⇄ Ba2+(р-р) + SO42-(р-р) N2 + 3 H2⇄ 2 NH3 6.5.2 Вычислите константу равновесия реакции N2 + 3 H2⇄ 2 NH3 при 250С, если стандартная энергия Гиббса образования аммиака при этой температуре 6.5.3 Определить температуру, при которой установится равновесие реакции из предыдущего задания, принимая, что все газы находятся в стандартных состояниях, а зависимостью DH0 и DS0 от температуры можно пренебречь. При решении задачи воспользоваться справочником физико-химических величин. 6.5.4 Равновесие реакции H2 + I2⇄ 2 HI установилось при концентрациях водорода, йода и йодоводорода, равных 0,3; 0,08; 0,35 моль/л соответственно. Определить исходные концентрации йода и водорода. 6.5.5 В какую сторону сместятся равновесия реакций: 2N2 + O2⇄ 2N2O; DН=56,90 кДж 2CO + O2⇄ 2CO2; DН= - 568,48 кДж 2НBr⇄H2 + Br2; DН= 59,83 кДж а) при понижении температуры, б) при повышении давления, в) при введении в реакционную смесь дополнительных количеств одного из продуктов реакции? 6.5.6 В каком направлении сместится равновесие обратимой реакции CO + H2O ⇄ CO2 + H2 + Q при понижении температуры? а) в сторону продуктов реакции; б) в сторону реакции, приводящей к уменьшению концентрации водорода; в) в сторону исходный веществ; г) температура не влияет на равновесие. 6.5.7 Какова сумма показателей степеней в числителе выражения для константы равновесия реакции 4HCl + O2 ⇄ 2H2O (г) + 2Cl2 ? а) 5; б) 2; в) 3; г) 4 6.5.8 В каком направлении сместится равновесие обратимой реакции PCl5 ⇄ PCl3 + Cl2 при увеличении концентрации хлора? а) равновесие не сместится; б) влево; в) в сторону реакции разложения; г) вправо.
6.6 Список рекомендуемой литературы
6.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с. 6.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с. 6.6.3 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 2008. 240 с. Лабораторная работа №7 |
||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 176. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
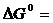
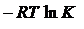 ,
,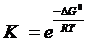 .
.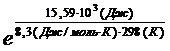 =0,0018
=0,0018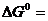 - 16,71 кДж/моль. В какую сторону смещено равновесие?
- 16,71 кДж/моль. В какую сторону смещено равновесие?