Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
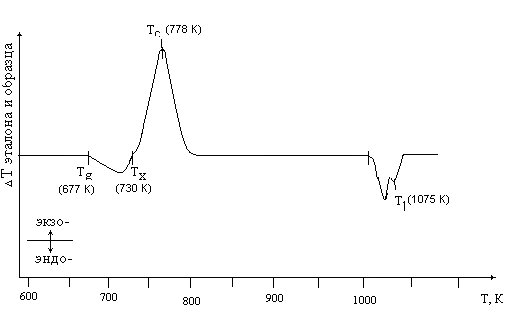
Термические характеристики стекол в системах ⇐ ПредыдущаяСтр 9 из 9 NaF – МеF2 – CdSO4 (Me – Ca, Ba) Образцы стекол, полученные в системах NaF – МеF2 – CdSO4 (Me – Ca, Ba) при охлаждении расплавов со скоростью ~ 103 град/с, были использованы для исследования их термической стабильности. Определение температуры стеклования (Тg), начала кристаллизации (Тх), максимума экзотермического пика кристаллизации (Тс) и температуры ликвидуса (Тl) для всех стеклообразных образцов проводили методом дифференциально-термического анализа (ДТА) при скорости нагрева образцов 15 град/мин. В качестве эталона использовали Al2O3. Ошибка в определении температур тепловых эффектов составляла 0,3 – 0,5 % от измеряемой величины. На рис. 3.12 – 3.13 приведены характерные термограммы стекол, образующихся в системеNaF – МеF2 – CdSO4 (Me – Ca, Ba), на которых показаны все проявляющиеся тепловые эффекты, соответствующие переходу стекла в состояние переохлажденного расплава, его кристаллизации и последующему плавлению.
Рис. 3.12 Дифференциально-термическая кривая стеклообразного образца состава 0,3NaF – 0,1СаF2 – 0,6CdSO4. ДТА-1М скорость нагрева 15 град/мин. Тg – температура стеклования, Тх – температура начала кристаллизации, Тс – температура максимума экзотермического пика кристаллизации, Тl – температура ликвидуса
Рис. 3.13. Дифференциально-термическая кривая образца стекла состава 0,3NaF – 0,1BaF2 – 0,6CdSO4. ДТА-1М. Тg – температура стеклования, Тх – температура начала кристаллизации; Тс – температура конца кристаллизации; Тl – температура ликвидуса
Методом дифференциально-термического анализа определены характеристические температуры синтезированных стекол, значения которых позволяют отнести данные стекла к числу легкоплавких. Результаты ДТА исследованных образцов стекол приведены в табл. 3.10 – 3.11, из которых видно: что температура стеклования (Tg) синтезированных стекол лежит в пределах 619-706 К для системы NaF – СaF2 – CdSO4, 485-515 К для системы NaF – BaF2 – CdSO4; температура начала кристаллизации (Tx) 672-764 для системы NaF – СaF2 – CdSO4, 520-540 для системы NaF – BaF2 – CdSO4; температура плавления (Тl) 998-1158 и для системы NaF – BaF2 – CdSO4 795-830 К.  Кристаллизация стекол протекает в одну стадию. Плавление образцов является одностадийным, реже двухстадийным процессом. Внутри области стеклообразования изменение температурных характеристик немонотонно. Таблица 3.10 Значения характеристических температур стекол, образующихся в системе NaF – СаF2 – CdSO4
Таблица 3.11 Значения характеристических температур стекол, образующихся в системе NaF – BaF2 – CdSO4
Для оценки термической стабильности полученных стекол использовали ряд критериев, к которым относят величину Тg, разницу между температурой начала кристаллизации и температурой стеклования ∆Т, критерий Груби Нr, и другие, рассчитанные значения которых представлены в табл. 3.12 – 3.13.
Таблица 3.12 Критерии термической стабильности фторсульфатных стекол, образующихся в системе NaF – СаF2 – CdSO4
Таблица 3.13 Параметры термической стабильности фторсульфатных стекол, образующихся в системе NaF – BaF2 – CdSO4
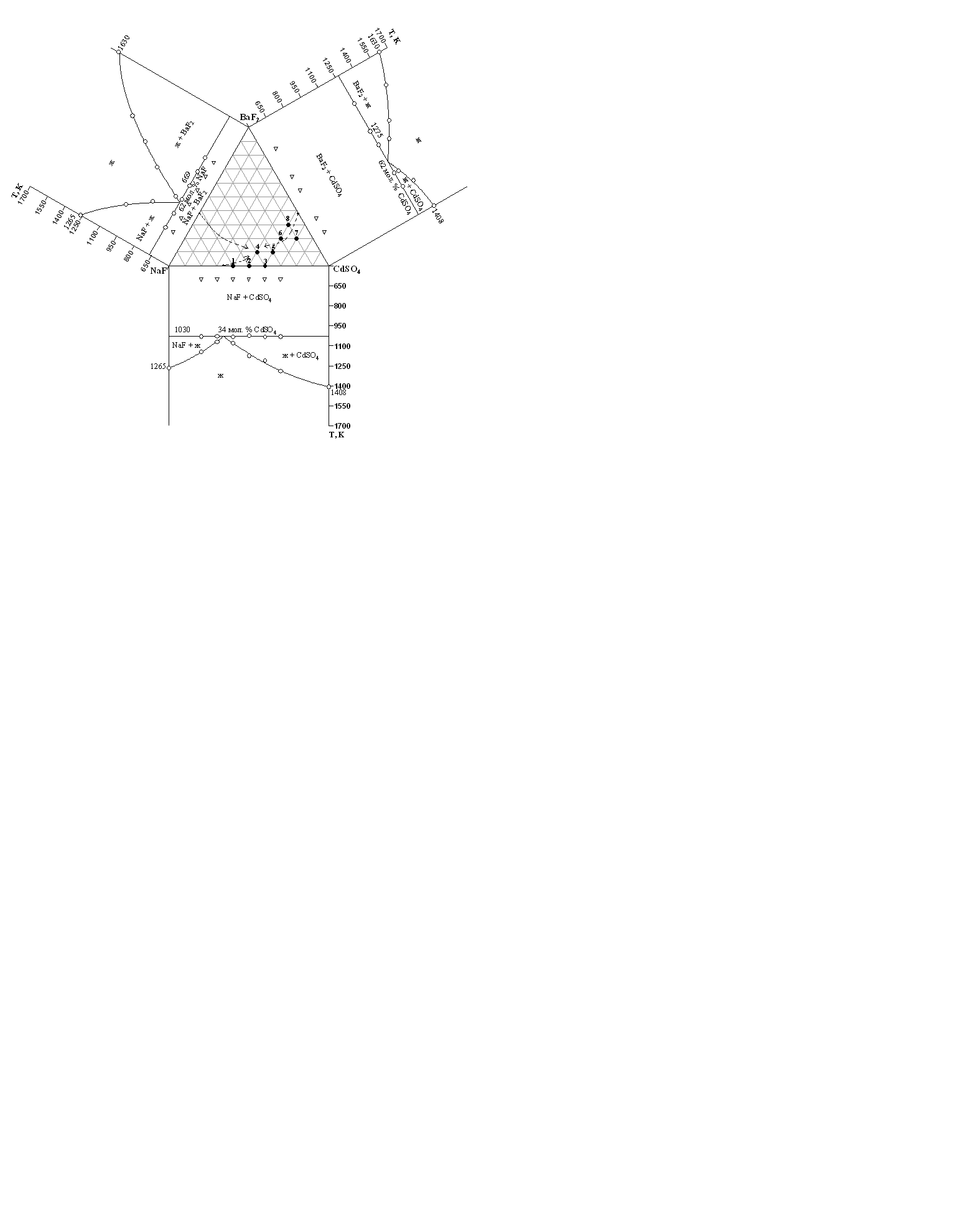
Как следует из таблиц 3.11 – 3.12, величина приведенной температуры стеклования Tg/Tl находится в пределах 0.61 – 0.63 для систем NaF – МеF2 – CdSO4 (Me – Ca, Ba), что достаточно хорошо коррелирует с правилом «двух третей», согласно которому для большинства стеклообразующих систем (как органических, так и неорганических) в широком интервале температур (100 – 2000 К) и при скоростях охлаждения расплава от 0.01 до 10 К/с, выполняется условие Tg/Tl ≈ 2/3. При этом, уменьшение приведенной температуры стеклования, трактуется как снижение тенденции системы к стеклообразованию. В нашем случае снижение величины Tg/Tl является незначительным, однако определены при высоких, до 1000 град/с, скоростях охлаждения расплавов. Величина Нr находится в пределах от 0,069 до 0,204, что свидетельствует о том, что стекла, образующиеся в тройной системе NaF – МеF2 – CdSO4 (Me – Ca, Ba) могут быть получены только при определенных условиях закаливания образцов, а именно, при высоких скоростях охлаждения расплавов. Однако, термическая устойчивость данных стекол невелика, что подтверждается небольшими термическими эффектами Тg и Тc на термограммах стеклообразных образцов [43]. Введение в стекло, образующееся по разрезу NaF – CdSO4, фторида кальция, фторида бария и повышение его содержания в стекле приводит к заметному увеличению практически всех критериев термической стабильности стекол. В то же время, стекла, содержащие фторид бария, по всем величинам критериев превосходят соответствующие величины для стекол, содержащих фторид кальция, что согласуется с правилом Захариасена, согласно которому термическая стабильность стекол увеличивается с увеличением ионного радиуса металла, являющегося модификатором сетки стекла [44]. По данным дифференциально-термического анализа стеклообразных образцов, синтезированных в тройных системах NaF – МеF2 – CdSO4 (Me = Ca, Ba), ориентировочно определены линии ликвидуса и состав тройных эвтектик. В системе NaF – СаF2 – CdSO4 тройная эвтектика ориентировочно приходится на состав 0,4NaF – 0,1СаF2 – 0,5CdSO4, температура плавления тройной эвтектики приблизительно 980 К. В системе NaF – BaF2 – CdSO4 ориентировочные координаты тройной эвтектики составляют 0,4NaF – 0,1BaF2 – 0,5CdSO4 при температуре около 940 К (рис. 3.14 – 3.15). Образцы данных составов имеют минимальную температуру ликвидуса и характеризуются максимальными значениями критериев термической стабильности, что соответствует положению о том, что наиболее высокой термической стабильностью обладают стекла, составы которых приходятся на эвтектику и эвтектические линии. Наименьшей термической стабильностью обладают стекла, составы которых соответствуют химическому соединению.
Рис. 3.14. Область стеклования и ориентировочная диаграмма плавкости системы NaF – СаF2 – CdSO4
Рис. 3.15. Область стеклования и ориентировочная диаграмма плавкости системы NaF – BaF2 – CdSO4
При относительном сравнении значений величин термической стабильности некоторых многокомпонентных фторидных стекол (табл. 3.14) с подобными значениями величин для полученных в данной работе стекол на основе сульфата кадмия, позволяет сделать вывод о более низкой стабильности стекол на основе CdSO4. Это закономерно должно приводить к существенному усложнению процесса получения стекол на основе сульфата кадмия, что отражается в высоких скоростях закаливания фторсульфатных расплавов. При небольших скоростях охлаждения (простая отливка расплава на металлическую пластину без дополнительного прессования расплава сверху другой пластиной) образцы были частично или полностью закристаллизованы.
Таблица 3.14 Параметры термической стабильности некоторых фторидных стекол
Таким образом, изучение стеклообразования в тройной системе NaF – МеF2 – CdSO4 (Me – Ca, Ba) показало, что при высоких (до 1000 град/с) скоростях закаливания, можно получить образцы, находящиеся в стеклообразном состоянии.
ВЫВОДЫ 1. Впервые построены диаграммы плавкости четырех систем CdSO4 – NaF; CaF2 – CdSO4; NaF – BaF2; BaF2 – CdSO4. Все диаграммы эвтектического типа без взаимной растворимости исходных компонентов. 2. В системах NaF – MeF2 – CdSO4 (Me – Ca, Ba) впервые расчетным путем определены области стеклования, границы которых подтверждены экспериментальными исследованиями. Область стеклования примыкает к бинарному разрезу NaF – CdSO4 и распространяется в направлении к BaF2, CaF2. 3. Определены характеристические температуры фторсульфатных стекол и рассчитаны критерии их термической стабильности. Для всех полученных стекол выполняется правило Каузмана (правило «двух третей»). Введение в кадмий - натриевые стекла фторидов кальция или бария приводит к заметному повышению их устойчивости к кристаллизации, что отражается в увеличении всех значений критериев термической стабильности. Критерий Груби (Нr) для всех стекол находится в пределах от 0.069 до 0.204, что свидетельствует о низкой термической стабильности стекол и требует высоких (более 100 град/с) скоростей охлаждения расплавов при синтезе стекол. 4. Все полученные стекла прозрачны в УФ, видимой и ИК областях спектра от 258-270 нм до 7-8 мкм. В длинноволновой области ограничение пропускания обусловлено началом фундаментального поглощения, а в коротковолновой – собственными колебаниями решетки. Синтезированные стекла являются диэлектриками, Еg = 4,6– 4,8 эВ
ЛИТЕРАТУРА 1. Петрова Е.М. Закономерности формирования структуры стекол на основе FeF3, GaF3, InF3 и ZrF4 / Автореф. дис. канд. хим. наук // Сибирск. гос. техн. ун-т.: Красноярск, 1998. -29с. 2. Байдаков Л.А. Количественный критерий стеклообразующей способности вещества на основе учета природы химической связи // Физика и химия стекла, 1994. Т.20. №3. С. 341-347. 3. Мазурин О.В. Стекло: природа и строение. - Л., 1985 4. Демкиной Л.И. Физико-химические основы производства оптического стекла. - Л.: Химия, 1976. С. 456. 5. Качалов Н.Н. Стекло. - М.: Изд-во АН СССР, 1959. 6. Шульц М.М., Мазурин О.В., Порай-Кошиц Е.А. Стекло: природа и строение. - Л.: Знание, 1985. С. 32. 7. Краева Н.В., Кертман А.В., Андреев О.В. Стеклообразование в системах Ga2S3-MeS-MeF2 (Me = Mg, Ca, Sr, Ba) // Тез. докл. Всеросс. конф. «Химия твердого тела и функциональные материалы»; УрО РАН. – Екатеринбург, 2004. С. 224. 8. Федоров П.П., Закалюкин Р.М., Игнатьева Л.Н., Бузник В.М. Фториндатные стекла // Успехи химии, 2000. Т.69. №8. С.767-779. 9. Плахотник В.Н. Фториды вокруг нас. // Соросовский образовательный журнал. №2, 1998. С.95. 10. Ахметов Н.С. Общая и неорганическая химия: Учеб. для вузов. - М.: Высшая школа, 1981. - 679 с. 11. Реми Г. Курс неорганической химии. В 2-х кн. Кн. 2. - М.: Мир, 1966. - 836 с. 12. Рипан Р., Четяну И. Неорганическая химия. - М.: Мир, 1971. - 560 с. 13. Некрасов Е.Б. Основы общей химии 3-е изд., испр. и доп. - М.: Химия, 1973. - 656 с. 14. Рысс И.Г. Химия фтора и его неорганических соединений. - М.: Госхимиздат, 1956. - 718 с. 15. Исикава Н., Кобаяси Е. Фтор: химия и применение. - М.: Мир, 1982. - 276 с. 16. Угай Я.А. Неорганическая химия: Учеб. для хим. спец. вузов. - М.: Высшая школа, 1989. - 463 с. 17. Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - 67 с. 18. Бабицына А.А., Емельянова Т.А., Федоров В.А. Стеклообразование в системах ZrF4 – BaF2 – AlF3 – NaF, ZrF4 – BaF2 – LaF3 – NaF, ZrF4 – BaF2 – LaF3 – AlF3. // Неорган. материалы, 2002. Т.38. №5. С. 622-631. 19. Байдаков Л.А, Блинов Л.Н., Почепцова Н.С. К вопросу о взаимосвязи стеклообразного состояния вещества с его фундаментальными характеристиками // Письма ЖТФ. 1986. Т.12. №15. С. 954-957. 20. Байдаков Л. А., Блинов Л. Н. О корреляции между атомно-структурными характеристиками расплавов и их способностью к стеклообразованию // Физ. и хим. стекла, 1987. Т.13. №3. С. 340-345. 21. Байдаков Л.А., Блинов Л.Н., Байдаков Е.Л. Квантовые характеристики атомов и стеклообразующая способность вещества // Изв. АН СССР. Неорган. Матер, 1989. Т.25. №9. С. 1582-1584. 22. Кертман А.В., Краева Н.В., Мичкарева В.В. и др. Математический прогноз стеклообразования в системах MeS-MeF2-Ga2S3 (Me=Mg,Ca,Sr,Ba) // Сб.трудов XVII Межд. научн. конф. «Математические методы в технике и технологии», 1-3 июня 2004, Кострома // Кострома: Изд-во КГТУ, 2004. Т.9, С.90-91. 23. Кертман А.В., Мичкарева В.В., Носов И.И. и др. Расчет и исследование стеклообразования в системах MeS-Ga2S3 (Me=Mg,Ca,Sr,Ba) // Вестник ТюмГУ, 2001. №3. С.192-197. 24. Диаграммы плавкости солевых систем. Часть I. Двойные солевые системы с общим анионом [от AgBr – CsBr до In2(WO4)3 – Rb2WO4]. Справочник. Под ред. В.И. Посыпайко, Е.А. Алексеевой. - М.: «МЕТАЛЛУРГИЯ», 1977. С. 415. 25. Аносов В.Я., Озерова М.И., Фиалков Ю.Я. Основы физико-химического анализа. - М.: Наука, 1976. 503 с. 26. Аносов В.Я., Погодин С.А. Основные начала физико-химического анализа. - М.: АН СССР, 1947. 863 с. 27. Курнаков Н.С. Введение в физико-химический анализ. - М.-Л.: АН СССР, 1940. 28. Погодин С.А. Физико-химический анализ. БСЭ – 3-е изд. - М. 1974. 29. Древинг В.П., Калашников Я.А. Правило фаз. - М.: Изд-во Моск. Унив., 1964. 454 с. 30. Погодин С.А. Фаз правило. БСЭ – 3-е изд. - М. 1974. 31. Ветроградский В.А., Егорова Л.С. Интерпретация термической кривой при дифференциально-термическом анализе. Инж. - физ. журн., 1979. Т.36. №3. 480 с. 32. Ковба Л.М., Трунов В.К. Рентгенофазовый анализ. - М.: Изд-во Моск. Университета, 1976. 232 с. 33. Андреев О.В., Хритохин Н.А., Кертман А.В. Рентгенография - Тюмень: ТюмГУ, 1990. 114 с. 34. Горелик С.С., Скаков Ю.А., Расторгуев Л.Н. Рентгенографический и электронно-оптический анализ. - М.: «МИСИС», 2002. - 358 с. 35. Кельнера Р., Мерме Ж.М, Отто М., Видмер М. Аналитическая химия. Проблемы и подходы. Пер. с англ. // - М.:Мир: ООО «Издательство АСТ», 2004. Т.1. 608 с. 36. Бахшиев Н. Г. Введение в молекулярную спектроскопию, 2-е изд. - Л.: 1987. 37. Коффи У., Ивенс М., Григолини П. Молекулярная диффузия и спектры. Пер. с англ., 1987. 38. Эльвинг Ф., Хортон Ч., Уиллард Х. Аналитическая химия фтора / в кн. Фтор и его соединения - М.: Иностр. лит-ра, 1956. Т.2. С. 45-178. 39. Кертман А.В., Игнатьева Л.В. Применение метода расчета стеклообразующей способности расплава к системам, содержащих тройное соединение // Вестник ТюмГУ, 2009. №.6. С. 241-245. 40. Игнатьева Л.В., Кертман А.В. Стеклообразование в системах NaF – MeF2 – CdSO4 (Me – Ca, Sr, Ba, Zn) // Проблемы теоретической и экспериментальной химии: тез. докл. XXI Росс. молодеж. науч. конф., посвящ. 150-летию со дня рожд. академика Н.Д. Зелинского, Екатеринбург, 19 - 23 апр. 2011 г. – Екатеринбург: Изд-во Урал. Ун-та, 2011. С. 336-337. 41. Ормонт Б.Ф. Введение в физическую химию и кристаллохимию полупроводников. / Б.Ф. Ормонт. – М.: Высшая школа, 1982. – 528 с. 42. Накомото К. ИК-спектры и спектры КР неорганических и координационных соединений: пер. с англ. / К. Накомото. – М.: Мир, 1991. – 536 с. 43. Кертман А.В., Игнатьева Л.В. Термическая стабильность стекол в системах NaF – MeF2 – CdSO4 (Me – Ca, Ba) // Вестник ТюмГУ, 2011. №5. С.195-199 44. Горшков В.С., Савельев В.Г., Федоров Н.Ф. Физическая химия силикатов и других тугоплавких соединений. – М.: Высшая школа, 1988. - 400 с.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-29; просмотров: 227. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |