
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Условие проявления и направление процессов переносаСтр 1 из 7Следующая ⇒ Раздел I Теоретические основы Технологических процессов Лекция 2 Механизмы и уравнения Основы теории переноса Основные понятия
Теоретическим фундаментом науки о процессах и аппаратах промышленной технологии являются следующие основные законы природы: -законы сохранения массы, энергии и импульса; -законы термодинамического равновесия; -законы переноса массы, энергии и импульса; -законы химической кинетики. Множество всех материальных объектов условно разбивают на систему и окружающую среду. Система (целое, составленное из частей) – множество элементов, находящихся в отношениях и связях друг с другом, образующих определенную целостность, единство. Система, полностью лишенная возможности взаимодействовать с окружающей средой, называется изолированной. Система, которой обменивается с окружающей средой только энергией, называется закрытой (замкнутой). Система, которая обменивается с окружающей средой веществом и энергией, называется открытой. Все физические величины, используемые для количественной характеристики системы, называется свойствами (параметрами). Свойства системы, являющиеся суммой соответствующих свойств подсистем, называются экстенсивными или аддитивными. Это масса, энтропия, теплота, энергия, количество движения (импульс), объем, электрический заряд и т.д. Свойства системы, не являющиеся суммой соответствующих свойств подсистем, называются интенсивными (неаддитивными). Эта температура, давление и химический потенциал. Любой экстенсивный параметр системы является субстанцией.  Каждая система по своему составу может быть либо гомогенной системой, или фазой, либо гетерогенной системой. Гомогеннойфазой называется вещество, физические и химические свойства которого во всех частях его объема одинаковы. Составляющие гомогенной системы перемешаны на молекулярном уровне. Например, смеси газов, жидкие и твердые растворы. Фазаимеет четкую границу раздела, называемую межфазной поверхностью, отделяющую ее от других фаз. На межфазной поверхности происходит скачкообразное изменение свойств системы. Различают три фазы: твердую, жидкую и газообразную. Гетерогенные системы состоят из нескольких фаз, каждая из которых определена от другой фазы межфазной поверхностью. Гетерогенные двухфазовые системы, которые широко распределены в промышленности, состоят Механизмы переноса субстанций
Можно выделить три механизма переноса субстанций: молекулярный, конвективный и турбулентный.
Молекулярный механизм Молекулярный механизм переноса субстанций обусловлен тепловым движением молекул. Взаимодействие между молекулами грубо можно представить как «жесткое» отталкивание на малых расстояниях между их центрами
Рис. 2.1. Типичный вид потенциала межмолекулярного взаимодействия Сила взаимодействия Кинетическая энергия молекул связана с температурой системы:
где wт – средняя скорость молекул; Mт – масса молекул., T – температура. Например, для кислорода при T = 0°C, wт = 461м/с. В газах молекулы движутся хаотически, без взаимодействия друг с другом (свободный пробег). При понижении температуры системы уменьшается Молекула, перемещаясь из одной точки пространства в другую, переносит все три вида субстанций – массу, импульс и энергию. В условиях равновесия макроскопический перенос субстанций не наблюдается, так как перенос молекул в любом направлении равновероятен. В отсутствии равновесия появляется молекулярный перенос масса в направлении от больших значении концентрации к меньшим, импульса – от больших значений скоростей к меньшим, энергии – от больших температур к меньшим. Перенос массы осуществляется только за счет поступательного переноса, т.е. за счет непосредственного перемещения молекулы из одной точки пространства в другую. Перенос импульса и энергии происходит как за счет поступательного переноса, так и за счет взаимодействия молекул (модель – столкновения твердых шаров). При столкновении молекул происходит изменение их скоростей, что приводит к так называемому столкновительному переносу импульса и энергии. В газах перенос импульс и энергия, в основном, за счет поступательного переноса, в жидкостях в основном за счет столкновения молекул. Конвективный механизм
Конвективный механизм переноса субстанции обусловлен движением макроскопических объемов среды как целого. Макроскопические величины могут даваться в каждой точке пространства путем усреднения микроскопических величин. Конвективная скорость Движение макроскопических объемов среды приводит к переносу массы Свободная конвекция происходит за счет силы тяжести, вынужденная вызывается искусственно, с использованием насосов, компрессорных машин, перемешиванием и т.д. Турбулентный механизм
Турбулентный механизмом переноса субстанции занимает промежуточное место между молекулярным и конвективными механизмами с точки зрения пространственно-временного масштаба. Турбулентный механизм переноса субстанции обусловлен развитием нерегулярного, хаотичного движения отдельных объемов (макрочастиц) из-за вихревых пульсаций на удалении от границы раздела фаз или стенки. Размер вихрей определяют масштаб турбулентности. Турбулентный механизм переноса реализуется на фоне конвективного. Для описания турбулентности используется временное осреднение физических величин (скорости,T, концентрации) на интервалах, значительно превышающих характерные периоды пульсации (рис. 2.2.):
Рис 2.2. Схема осреднения скорости
Тогда скорость вихря
где Интенсивность турбулентности характеризуется как
Турбулентные вихри осуществляет перенос субстанций. Отличие от молекулярного механизма заключается в масштабе вихрей и отсутствие столкновительного переноса субстанций, т.к. при столкновении вихрей происходит их смешение, а не упругое взаимодействие.
Условие проявления и направление процессов переноса
Если система находится в равновесии, то макроскопического переноса субстанции не происходит. Тепловое движение молекул по всем направлениям равновероятны. Равновесию в однофазной (гомогенной) системе соответствует равенство значений макроскопических величин во всех ее точках:
T(x ,y, z, t) = const, (2.5.)
где Условием равновесия в двухфазной системе является равенство этих величин в фазах:
Условия гидродинамического, теплового и концентрационного равновесия:
T = const, где
Условием проявления процессов переноса является неравновесность системы для отдельных видов субстанций. Направленность процесса переноса определяется самопроизвольным стремлением системы к состоянию равновесия, т.е. выравниванию скорости, температуры и химических потенциалов компонентов системы. Причем, внутри фазы тепло переносится в направлении понижения T, импульс – в направлении уменьшения Для того чтобы осуществить процесс, систему необходимо вывести из состояния равновесия, оказывая внешнее воздействие. |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 233. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
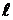 и «мягкое» притяжения на больших. На рис. 2.1. представлены изменения
и «мягкое» притяжения на больших. На рис. 2.1. представлены изменения  - потенциальной энергии межмолекулярного взаимодействия - в зависимости от
- потенциальной энергии межмолекулярного взаимодействия - в зависимости от 
 до
до  КТ, (2.1.)
КТ, (2.1.) . Они теряют возможность преодолевать силы межмолекулярного взаимодействия и система, конденсируясь, переходит из газового состояния в жидкое. Возрастает роль межмолекулярного взаимодействия. При дальнейшем понижении температуры система переходит в кристаллическое состояние. Образуется структура кристаллической решетки. Преобладающим является тепловое движение молекул внутри ячейки.
. Они теряют возможность преодолевать силы межмолекулярного взаимодействия и система, конденсируясь, переходит из газового состояния в жидкое. Возрастает роль межмолекулярного взаимодействия. При дальнейшем понижении температуры система переходит в кристаллическое состояние. Образуется структура кристаллической решетки. Преобладающим является тепловое движение молекул внутри ячейки. (x,y,z,t) устанавливается путем осреднения случайных значений молекулярных характеристик в системе для макроскопической величины.
(x,y,z,t) устанавливается путем осреднения случайных значений молекулярных характеристик в системе для макроскопической величины. (плотность = масса в единице объема), импульса
(плотность = масса в единице объема), импульса  (энергия единичного объема). Различают свободную и вынужденную конвекцию:
(энергия единичного объема). Различают свободную и вынужденную конвекцию:
 . (2.2.)
. (2.2.) :
: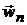 , (2.3.)
, (2.3.) - скорость пульсации.
- скорость пульсации. . (2.4.)
. (2.4.) (x, y, z, t) = const,
(x, y, z, t) = const, ,
, , (2.6.)
, (2.6.)
 - гидромеханическое равновесие;
- гидромеханическое равновесие; - тепловое равновесие; (2.7.)
- тепловое равновесие; (2.7.) - концентрационное равновесие;
- концентрационное равновесие; - дифференциальный оператор.
- дифференциальный оператор.