
Студопедия
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
|
Глава 7. Биосинтез холестерина.
Из общего количества холестерина, содержащегося в организме, только 20% его поступает вместе с пищей. Основное количество холестерина синтезируется в организме с участием кофермента ацетил-КоА. Холестерин - это довольно важный метаболит, который играет важную роль в обеспечении барьерной функции клеточных мембран, служит основой для синтеза стероидных гормонов. Кроме того, он предохраняет клеточные мембраны от электрического пробоя и препятствует аутоокислению мембранных липидов. Недостаток холестерина (гипохолестеринемия) может обернуться повышением риска опухолевых и вирусных заболеваний. Однако избыток холестерина (гиперхолестеринемия) затрудняет перенос ионов кальция и его концентрация в цитоплазме повышается. Это приводит к повышенному делению клеток и развитию атеросклероза.
Холестерин поступает в организм с пищей через желудочно-кишечный тракт. Считается, что в среднем каждый человек с различными продуктами потребляет в день 0,5 г холестерина. Также, холестерин синтезируется в самом организме. Все клетки, кроме эритроцитов, обладают способностью синтезировать холестерин, однако основная его масса синтезируется в печени. В день организм среднего человека синтезирует 1 г холестерина. Из этого холестерина 20% синтезируется в клетках, а 80% в печени.
Большая доля холестерина (800 мг) синтезируется в печени, меньшая часть (500 мг) поступает с пищей и еще меньшая (200 мг) синтезируется клетками организма.
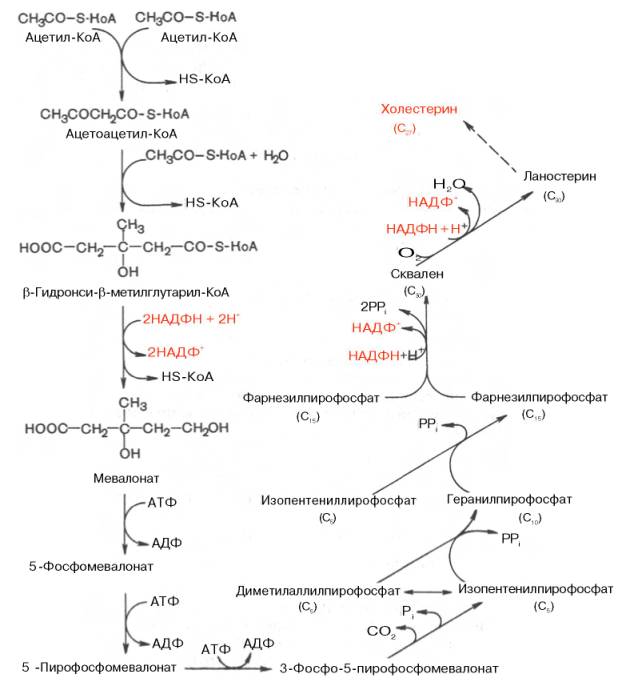
В синтезе холестерина можно выделить три основные стадии: I – превращение активного ацетата в мевалоновуюкислоту, II – образование сквалена из мевалоновойкислоты, III – циклизациясквалена в холестерин.
Рассмотрим стадию превращения активного ацетата в мевалоновуюкислоту. Начальным этапом синтеза мевалоновойкислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазнойреакции:
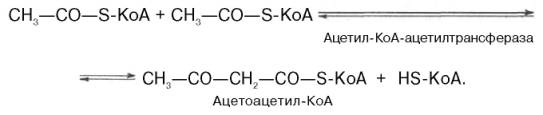 Затем при последующей конденсацииацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Затем при последующей конденсацииацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
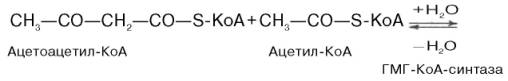
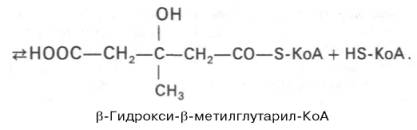 Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновуюкислоту:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновуюкислоту:
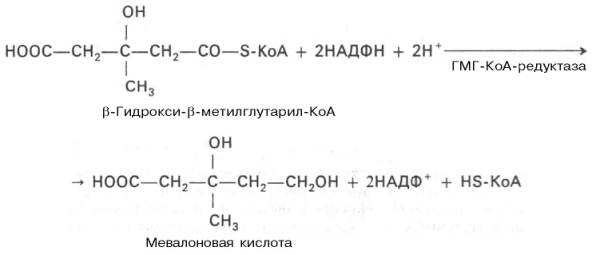 ГМГ-КоА-редуктазнаяреакция – первая практически необратимая реакция в цепи биосинтезахолестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтезахолестерина.
Наряду с классическим путем биосинтезамевалоновойкислоты имеется второй путь, в котором в качестве промежуточного субстрата, по-видимому, образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновойкислоты по этому пути принимает участие ацетил-КоА-карбоксилаза – фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновойкислоты – 2 молекулы ацетил-КоА на 1 молекулумалонил-КоА.
Физиологическая роль второго пути окончательно не изучена. Полагают, что он имеет определенное значение не только для синтеза веществ нестероидной природы, таких, как боковая цепь убихинона, некоторых тРНК, но и для биосинтезастероидов.
На II стадии синтеза холестеринамевалоноваякислота превращается в сквален. Реакции II стадии начинаются с фосфорилированиямевалоновойкислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновойкислоты:
ГМГ-КоА-редуктазнаяреакция – первая практически необратимая реакция в цепи биосинтезахолестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтезахолестерина.
Наряду с классическим путем биосинтезамевалоновойкислоты имеется второй путь, в котором в качестве промежуточного субстрата, по-видимому, образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновойкислоты по этому пути принимает участие ацетил-КоА-карбоксилаза – фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновойкислоты – 2 молекулы ацетил-КоА на 1 молекулумалонил-КоА.
Физиологическая роль второго пути окончательно не изучена. Полагают, что он имеет определенное значение не только для синтеза веществ нестероидной природы, таких, как боковая цепь убихинона, некоторых тРНК, но и для биосинтезастероидов.
На II стадии синтеза холестеринамевалоноваякислота превращается в сквален. Реакции II стадии начинаются с фосфорилированиямевалоновойкислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновойкислоты:
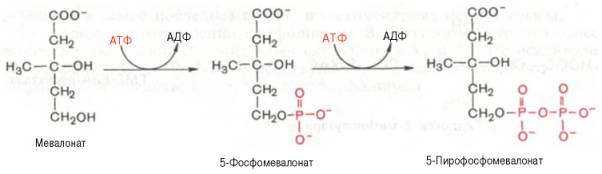 5-пирофосфомевалоновая кислота в результате последующего фосфо-рилирования третичной гидроксильной группы образует нестабильный промежуточный продукт – 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясьи теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметил-аллилпирофосфат:
5-пирофосфомевалоновая кислота в результате последующего фосфо-рилирования третичной гидроксильной группы образует нестабильный промежуточный продукт – 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясьи теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметил-аллилпирофосфат:
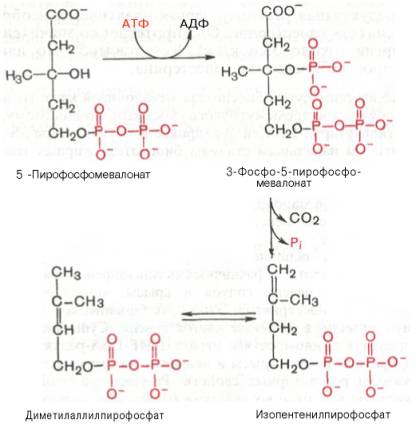 Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофос-фат и изопентенилпирофосфат) конденсируются с высвобождением пи-рофосфата и образованием геранилпирофосфата:
Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофос-фат и изопентенилпирофосфат) конденсируются с высвобождением пи-рофосфата и образованием геранилпирофосфата:
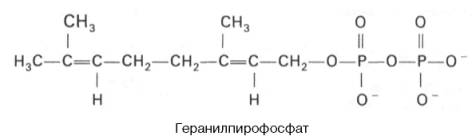 К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат:
К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат:
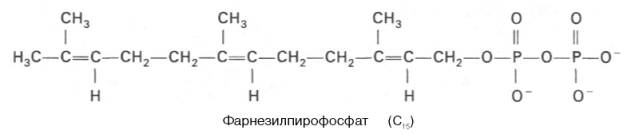 В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2 молекулфарнезилпирофосфата образуется сквален:
В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2 молекулфарнезилпирофосфата образуется сквален:
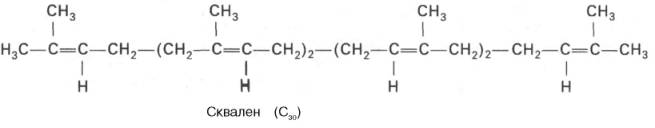 На III стадии биосинтезахолестеринасквален под влиянием сквален-оксидоциклазыциклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены):
На III стадии биосинтезахолестеринасквален под влиянием сквален-оксидоциклазыциклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены):
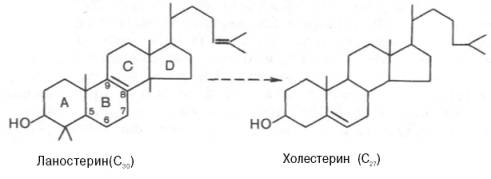 Начиная со сквалена, все промежуточные продукты биосинтезахолестерина (включая и холестерин) нерастворимы в водной среде. Поэтому они участвуют в конечных реакцияхбиосинтезахолестерина, будучи связанными со стеринпереносящимибелками (СПБ). Это обеспечивает их растворимость в цитозолеклетки и протекание соответствующих реакций. Данный факт имеет важное значение и для вхождения холестерина в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны.
Как отмечалось, реакцией, регулирующей скорость биосинтезахолестерина в целом, является восстановлениеβ-гидрокси-β-метилглутарил-КоА в мевалоновуюкислоту, катализируемое ГМГ-КоА-редуктазой. Данный фермент испытывает регуляторное воздействие ряда
факторов. В частности, скорость синтеза редуктазы в печени подвержена четким суточным колебаниям: максимум ее приходится на полночь, а минимум – на утренние часы.
Приводим общую схему синтеза холестерина:
Начиная со сквалена, все промежуточные продукты биосинтезахолестерина (включая и холестерин) нерастворимы в водной среде. Поэтому они участвуют в конечных реакцияхбиосинтезахолестерина, будучи связанными со стеринпереносящимибелками (СПБ). Это обеспечивает их растворимость в цитозолеклетки и протекание соответствующих реакций. Данный факт имеет важное значение и для вхождения холестерина в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны.
Как отмечалось, реакцией, регулирующей скорость биосинтезахолестерина в целом, является восстановлениеβ-гидрокси-β-метилглутарил-КоА в мевалоновуюкислоту, катализируемое ГМГ-КоА-редуктазой. Данный фермент испытывает регуляторное воздействие ряда
факторов. В частности, скорость синтеза редуктазы в печени подвержена четким суточным колебаниям: максимум ее приходится на полночь, а минимум – на утренние часы.
Приводим общую схему синтеза холестерина:
 Активность ГМГ-редуктазы возрастает при введении инсулина и тире-оидныхгормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови.
При голодании, тиреоидэктомии, введение глюкагона и глюкокорти-коидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГ-КоА-редуктазы.
Активность ГМГ-редуктазы возрастает при введении инсулина и тире-оидныхгормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови.
При голодании, тиреоидэктомии, введение глюкагона и глюкокорти-коидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГ-КоА-редуктазы.
| 
| Накопленный холестерин подвергается различным превращениям и выводится из организма.
Часть холестеринового фонда в организме постоянно окисляется, преобразуясьвразличного рода стероидные соединения. Основной путь окисления холестерина - это образование желчных кислот. На эти цели уходит от 60 до 80% всего ежедневно образующегося в организме холестерина.
Второй окислительный путь превращения холестерина - это образование стероидных гормонов (половые гормоны, гормоны коры надпочечников и др.). На эти цели уходит всего 2-4% холестерина, образующегося в организме.
Другим путем превращения холестерина является образование из него в коже под действием ультрафиолетовых лучей витамина Д3. Следующим производным холестерина является холестанос. Его роль в организме пока еще не выяснена. Известно лишь, что он активно накапливается в надпочечниках и составляет 16% от всех находящихся там стероидов.
С мочой в сутки у человека выделяется около 1 мг холестерина.
Со слущивающимся эпителием кожи теряется до 100 мг/сут холестерина.
|


 Затем при последующей конденсацииацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Затем при последующей конденсацииацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
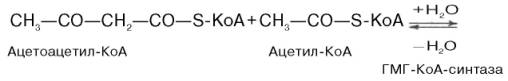
 Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновуюкислоту:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновуюкислоту:
 ГМГ-КоА-редуктазнаяреакция – первая практически необратимая реакция в цепи биосинтезахолестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтезахолестерина.
Наряду с классическим путем биосинтезамевалоновойкислоты имеется второй путь, в котором в качестве промежуточного субстрата, по-видимому, образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновойкислоты по этому пути принимает участие ацетил-КоА-карбоксилаза – фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновойкислоты – 2 молекулы ацетил-КоА на 1 молекулумалонил-КоА.
Физиологическая роль второго пути окончательно не изучена. Полагают, что он имеет определенное значение не только для синтеза веществ нестероидной природы, таких, как боковая цепь убихинона, некоторых тРНК, но и для биосинтезастероидов.
На II стадии синтеза холестеринамевалоноваякислота превращается в сквален. Реакции II стадии начинаются с фосфорилированиямевалоновойкислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновойкислоты:
ГМГ-КоА-редуктазнаяреакция – первая практически необратимая реакция в цепи биосинтезахолестерина. Она протекает со значительной потерей свободной энергии (около 33,6 кДж). Установлено, что данная реакция лимитирует скорость биосинтезахолестерина.
Наряду с классическим путем биосинтезамевалоновойкислоты имеется второй путь, в котором в качестве промежуточного субстрата, по-видимому, образуется не β-гидрокси-β-метилглутарил-КоА, а β-гидрокси-β-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновойкислоты по этому пути принимает участие ацетил-КоА-карбоксилаза – фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. Оптимальное соотношение малонил-КоА и ацетил-КоА для синтеза мевалоновойкислоты – 2 молекулы ацетил-КоА на 1 молекулумалонил-КоА.
Физиологическая роль второго пути окончательно не изучена. Полагают, что он имеет определенное значение не только для синтеза веществ нестероидной природы, таких, как боковая цепь убихинона, некоторых тРНК, но и для биосинтезастероидов.
На II стадии синтеза холестеринамевалоноваякислота превращается в сквален. Реакции II стадии начинаются с фосфорилированиямевалоновойкислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновойкислоты:
 5-пирофосфомевалоновая кислота в результате последующего фосфо-рилирования третичной гидроксильной группы образует нестабильный промежуточный продукт – 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясьи теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметил-аллилпирофосфат:
5-пирофосфомевалоновая кислота в результате последующего фосфо-рилирования третичной гидроксильной группы образует нестабильный промежуточный продукт – 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясьи теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметил-аллилпирофосфат:
 Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофос-фат и изопентенилпирофосфат) конденсируются с высвобождением пи-рофосфата и образованием геранилпирофосфата:
Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофос-фат и изопентенилпирофосфат) конденсируются с высвобождением пи-рофосфата и образованием геранилпирофосфата:
 К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат:
К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат:
 В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2 молекулфарнезилпирофосфата образуется сквален:
В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2 молекулфарнезилпирофосфата образуется сквален:
 На III стадии биосинтезахолестеринасквален под влиянием сквален-оксидоциклазыциклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены):
На III стадии биосинтезахолестеринасквален под влиянием сквален-оксидоциклазыциклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены):
 Начиная со сквалена, все промежуточные продукты биосинтезахолестерина (включая и холестерин) нерастворимы в водной среде. Поэтому они участвуют в конечных реакцияхбиосинтезахолестерина, будучи связанными со стеринпереносящимибелками (СПБ). Это обеспечивает их растворимость в цитозолеклетки и протекание соответствующих реакций. Данный факт имеет важное значение и для вхождения холестерина в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны.
Как отмечалось, реакцией, регулирующей скорость биосинтезахолестерина в целом, является восстановлениеβ-гидрокси-β-метилглутарил-КоА в мевалоновуюкислоту, катализируемое ГМГ-КоА-редуктазой. Данный фермент испытывает регуляторное воздействие ряда
факторов. В частности, скорость синтеза редуктазы в печени подвержена четким суточным колебаниям: максимум ее приходится на полночь, а минимум – на утренние часы.
Приводим общую схему синтеза холестерина:
Начиная со сквалена, все промежуточные продукты биосинтезахолестерина (включая и холестерин) нерастворимы в водной среде. Поэтому они участвуют в конечных реакцияхбиосинтезахолестерина, будучи связанными со стеринпереносящимибелками (СПБ). Это обеспечивает их растворимость в цитозолеклетки и протекание соответствующих реакций. Данный факт имеет важное значение и для вхождения холестерина в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны.
Как отмечалось, реакцией, регулирующей скорость биосинтезахолестерина в целом, является восстановлениеβ-гидрокси-β-метилглутарил-КоА в мевалоновуюкислоту, катализируемое ГМГ-КоА-редуктазой. Данный фермент испытывает регуляторное воздействие ряда
факторов. В частности, скорость синтеза редуктазы в печени подвержена четким суточным колебаниям: максимум ее приходится на полночь, а минимум – на утренние часы.
Приводим общую схему синтеза холестерина:
 Активность ГМГ-редуктазы возрастает при введении инсулина и тире-оидныхгормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови.
При голодании, тиреоидэктомии, введение глюкагона и глюкокорти-коидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГ-КоА-редуктазы.
Активность ГМГ-редуктазы возрастает при введении инсулина и тире-оидныхгормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови.
При голодании, тиреоидэктомии, введение глюкагона и глюкокорти-коидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГ-КоА-редуктазы.
