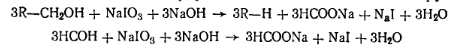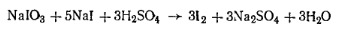Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение массовой доли метилольных групп.Метод основан на взаимодействии метилольных групп и свободного формальдегида с иодом в щелочной среде. Иод в щелочной среде переходит в иодат:
Иодат натрия окисляет формальдегид и метилольные группы:
После этого прибавляют серную кислоту, чтобы выделить иод из оставшегося иодата натрия и эквивалентного ему количества иодида натрия:
Выделившийся в свободном виде иод оттитровывают тиосульфатом натрия:
Молярная масса эквивалента формальдегида равна 1/2 массы его моля. Таким образом определяют сумму метилольных групп и свободного формальдегида. Вычитая из нее массовую долю свободного формальдегида, найденную по реакции с сульфитом натрия в кислой среде, определяют массовую долю метилольных групп. Для растворимых в воде смол определения проводят непосредственно в растворе навески. Для определения массовой доли метилольных групп в смолах, нерастворимых в воде, пробу предварительно обрабатывают 20%-ным раствором гидроксида натрия, а затем определяют массовые доли формальдегида и метилольных групп в продуктах щелочного гидролиза смолы.
Реактивы и оборудование
Гидроксид натрия, 20%-ный раствор Бюкс для взятия навески Гидроксид натрия, 1 н. раствор Колба мерная на 250 мл Иод, 0,1 н. раствор Колба коническая на 250 мл с при- Серная кислота, 1 и. раствор шлифованной пробкой Тиосульфат натрия, 0,1 н. раствор Цилиндры мерные на 10 и 25 мл Крахмал растворимый, 1%-ный раст- Пипетки на 10 и 20 мл вор
Ход определения. Навеску смолы ~1,5 г, взятую с точностью до 0,0002 г, переносят в мерную колбу емкостью 250 мл и приливают 10 мл 20%-ного водного раствора гидроксида натрия (для смол, нерастворимых в воде). После энергичного взбалтывания раствор разбавляют дистиллированной водой до метки (если раствор содержит нерастворившиеся взвешенные частички, его необходимо фильтровать).  Помещают 10 мл приготовленного раствора в коническую колбу емкостью 250 мл с притертой пробкой, прибавляют пипеткой 20 мл 0,1 н. раствора иода и 10 мл 1 н. раствора гидроксида натрия. Через 10 мин к раствору прибавляют 15 мл1 н. раствора серной кислоты и выделившийся иод титруют 0,1 н. раствором тиосульфата натрия до обесцвечивания, прибавляя к концу титрования несколько капель крахмала. Параллельно проводят контрольный опыт. Массовые доли метилольных групп и формальдегида ω2 (%) в пересчете на формальдегид вычисляют по формуле
где V1 — объем 0,1 н. раствора тиосульфата натрия, израсходованный на титрование в контрольном опыте; V2— объем 0,1 н. раствора тиосульфата натрия, израсходованный на титрование исследуемого раствора; К — коэффициент поправки для 0,1 н. раствора тиосульфата натрия; 0,0015 — масса формальдегида, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия, г; т — масса навески смолы. Массовую долю метилольных групп ω3 (%) вычисляют по формуле
где ω2 — массовые доли метилольных групп и формальдегида в пересчете на формальдегид; ω1— массовая доля формальдегида; 31 и 30 — молекулярные массы соответственно метилольной группы и формальдегида.
ГЛАВА 10 |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 474. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |