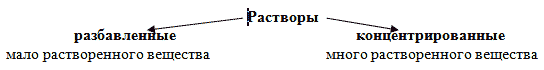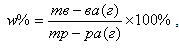Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Хлор в периодической системе. Основные соединения хлора. Физические и химические свойства.Хлор входит в подгруппа галогенов. Все элементы данной подгруппы - ярко выраженные неметаллы. В свободном состоянии галогены образуют вещества, состоящие из двухатомных молекул F2, Cl2, Br2, I2. Свойства хлора.
Получение хлора. 1.Электролиз хлоридов 2KCl Химические свойства хлора.
Применение хлора. применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбелки целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. Вода - растворитель. Вода является самым распространенным растворителем на Земле. Растворы – это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия. Растворимость – способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы Зависит:
В зависимости от природы растворяемых веществ все вещества делятся на:
В зависимости от температуры: чем выше температура раствора, тем выше растворимость веществ.  Растворы бывают:
Один из способов выражения концентрации растворов – массовая доля (w)
3. Допишите уравнения химических реакций, определите тип реакции, расставьте коэффициенты: Fe + H2S04= FeSO4 + H2 MgCI2 + Ва(ОН)2= Mg(OH)2 + BaCl2 3NaOH + Fe= Fe(NaOH)3 Билет-21 |
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 263. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 2K+ Cl2
2K+ Cl2 HCl + HClO(хлорная вода)
HCl + HClO(хлорная вода)