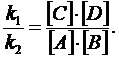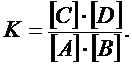Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Скорость химической реакцииСкорость химического процесса - изменение концентрации вещества за единицу времени в единице реакционного пространства. Если в момент времени t1 концентрация реагирующего вещества была равной С1 моль/л, а в последующий момент времени С2 моль/л, то отношение
выражает среднюю скорость реакции υ за промежуток времени t2-t1 = Dt. Чем меньше промежуток времени Dt и соответствующая ему убыль DС, тем ближе отношение Скорость реакции всегда остается положительной. Отношение же Скорость химической реакции зависит от природы реагирующих веществ, от их концентрации, от температуры, от наличия катализаторов, а также от общего давления (для реакций в газовой фазе) и от площади поверхности раздела фаз (для гетерогенных реакций). Зависимость скорости элементарной реакции от концентрации выражается законом действия масс: скорость реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных соответствующим коэффициентам в уравнении реакции. Так, скорость гомогенной реакции mA + nB = dC v = k[A]m[B]n, где k – коэффициент пропорциональности, называемый константой скорости. Физический смысл константы скорости: k – это скорость, когда концентрации реагирующих веществ равны единице (1 моль/л). Константа скорости зависит от природы реагирующих веществ и от температуры.  Для газообразных веществ вместо концентраций можно использовать парциальные давления. Концентрация твердого вещества является обычно постоянной величиной и входит в константу скорости. Так, скорость реакции CuO(тв) + H2(г) = H2O(г) + Cu(тв) v = k[H2]. При увеличении температуры на 100С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа).
или
Математическое выражение правила Вант-Гоффа: Vt2/Vt1 = γ(t2-t1)/10 Химическое равновесие Очень многие химические реакции не доходят до конца потому, что продукты реакции, взаимодействуя между собой, вновь образуют исходные вещества. Такие реакции называются обратимыми. Для обратимых реакций в химическом уравнении вместо знака равенства ставится знак обратимости: A + В ↔ С + D. Обратимые химические реакции в конечном счете приводят к состоянию химического равновесия. Под химическим равновесием понимают такое состояние системы, когда скорость прямого процесса Химическое равновесие есть равновесие динамическое: непрерывно протекают две противоположно направленные реакции, концентрации же реагирующих веществ остаются при этом неизменными. Концентрации реагирующих веществ, достигаемые при равновесии, называются равновесными концентрациями. Легко вывести ту зависимость, которой связаны равновесные концентрации. Пусть
Так как k1 и k2 – для данной температуры величины постоянные, то их отношение для той же температуры – также постоянная величина К, которая называется константа равновесия:
Это уравнение представляет собой другое выражение закона действия масс. Константа равновесия К показывает, во сколько раз константа скорости прямой реакции больше константы скорости обратной реакции. В этом физический смысл величины К. Константа равновесия не зависит от исходных концентраций реагирующих веществ, но зависит от их природы и температуры. Равновесные концентрации могут быть различны, но они связаны между собой так, что всегда отношение их произведений есть величина постоянная. Принцип Ле Шателье гласит: если изменить одно из условий, при которых система находится в равновесии, то равновесие смещается в направлении той реакции, которая противодействует произведенному изменению: - увеличение концентраций исходных веществ или уменьшение концентраций продуктов реакции смещает равновесие в сторону прямой реакции; - понижение температуры смещает равновесие в сторону экзотермической реакции (реакция с выделением теплоты и ∆Н<0), повышение температуры смещает равновесие в сторону эндотермической реакции (реакция с поглощением теплоты и ∆H>0); - повышение давления смещает равновесие в сторону процесса, идущего с уменьшением объема газов.
ПРАКТИЧЕСКАЯ ЧАСТЬ Цель работы: изучить факторы, влияющие на скорость химической реакции и факторы, влияющие на смещение химического равновесия. Оборудование и материалы: термостат или водяная баня сплиткой электрической, секундомер, пробирки, пипетки, спиртовка. Реактивы:диоксид марганца, NH4Cl крист, вода дист.,; растворы: Na2S2О3 (0,15 М), свежеприготовленный, 0,15 М серной кислоты (0,15 М), FeCl3 (0,02 н), NH4CNS (0,02 н), FeCl3 (насыщ.), NH4CNS (насыщ.), крахмала (свежепригот.), йодная вода, пероксида водорода.. Ход работы В данной работе зависимость скорости реакции от концентрации реагирующих веществ и температуры изучается на примере самопроизвольного разложения тиосерной кислоты (Н2S2О3) – опыты 1 и 2. Известно, что соли тиосерной кислоты устойчивы как в твердом состоянии, так и в растворе, сама же кислота неустойчива даже в разведенном растворе и самопроизвольно разлагается с образованием сернистой кислоты и свободной серы. Сернистая кислота также разлагается на сернистый газ и воду. Таким образом, при добавлении к раствору, например, тиосульфата натрия серной кислоты будут протекать реакции: Na2S2О3 + Н2SО4 = Н2S2О3 + Na2SО4 Н2S2О3= Н2SО3 + S Н2SО3= Н2О + SО2 Первая реакция идет практически мгновенно, так же мгновенно устанавливается химическое равновесие между сернистой кислотой, сернистым газом и водой, а скорость всего процесса определяется скоростью наиболее медленной второй реакции, которую и предлагается изучить. Опыт основывается на следующем: разложение тиосерной кислоты сопровождается выделением эквивалентного количества коллоидной серы, так что по плотности ее суспензии можно судить о количестве разложившейся тиосерной кислоты. Проводятся опыты в пробирке, на задней стенке которой проведена цветная полоска. В начале опыта эта полоска четко просматривается через прозрачный раствор Na2S2О3, но после добавления раствора Н2S2О4 через некоторое время раствор делается мутным и цветная полоска становится почти невидимой. В разных опытах определяется время с момента сливания растворов тиосульфата натрия и серной кислоты (начало реакции) до начала видимого исчезновения цветной полоски (конец опыта). |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 495. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
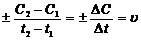
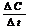 к истинной скорости реакции в соответствующий момент времени.
к истинной скорости реакции в соответствующий момент времени.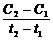 пишется со знаком минус, если же измеряется концентрация какого-либо из получающихся веществ, то выражению
пишется со знаком минус, если же измеряется концентрация какого-либо из получающихся веществ, то выражению 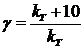 Изменение скорости химической реакции с температурой характеризуется температурным коэффициентом скорости γ, который представляет собой отношение констант скоростей при температурах (Т+10) и Т:
Изменение скорости химической реакции с температурой характеризуется температурным коэффициентом скорости γ, который представляет собой отношение констант скоростей при температурах (Т+10) и Т: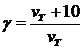

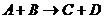 равна скорости обратного процесса
равна скорости обратного процесса 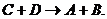
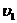 - скорость прямой реакции;
- скорость прямой реакции; 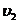 - скорость обратной реакции. Скорость прямой реакции выражается уравнением
- скорость обратной реакции. Скорость прямой реакции выражается уравнением 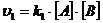 , а скорость обратной реакции
, а скорость обратной реакции 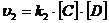 , где k1 – константа скорости прямой реакции; k2 – константа скорости обратной реакции. При равновесии
, где k1 – константа скорости прямой реакции; k2 – константа скорости обратной реакции. При равновесии 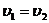 , отсюда
, отсюда