Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ УГЛЕКИСЛОГО ГАЗА И МОЛЯРНЫХ МАСС ЭКВИВАЛЕНТОВ ВЕЩЕСТВ1. Относительной молекулярной массой (далее «молекулярная масса») Мr называется отношение массы молекулы к 1/12 часть массы атома самого легкого природного изотопа углерода 12С. Таким образом, относительная молекулярная масса — величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы изотопа 12С, т.е., величина безразмерная. Численно молекулярная масса вещества равна сумме относительных атомных масс всех элементов, образующих данное вещество. В химических расчетах в качестве основной единицы количества вещества используется моль – количество вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов, радикалов, электронов т т.д.), сколько содержится атомов в 0, 012 кг изотопа 12С. Число структурных элементов, содержащихся в 1 моль любого вещества, называется числом Авогадро (NA). Его приближенное значение составляет 6,02 * 1023 моль-1. Количество вещества n (моль) можно найти по формуле: n = m/M, (1) где m – масса вещества, г; М – молярная масса вещества, г/моль. Молярная масса вещества – это масса одного моля вещества, выражается в г/моль или кг/моль. Численно молрная масса вещества равна его относительной молекулярной массе. Молекулярные массы газообразных веществ, а также легколетучих жидкостей можно определять, пользуясь законом Авогадро. Согласно последнему, в равных объемах всех газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул. Возьмем равные объемы (например, 1 л) двух различных газов; тогда m1 = N1 · Mr1 и m2 = N2 · Mr2, где mi – масса взятого объема газа;  Ni – число молекул, содержащееся во взятом объеме; Мri – молекулярная масса газа. Индексы 1 и 2 относятся к первому и второму газам. По закону Авогадро N1 = N2, Следовательно, Отношение массы одного газа к массе такого же объема другого газа (при одинаковых р и t) называется относительной плотностью первого газа по второму, т. е. Принимая во внимание (2) и (3), полуаем: Mr1 = Mr2 · D (4) Аналогично M1 = M2 · D (5) Молекулярную массу какого-либо газа можно рассчитать и в том случае, если известна его относительная плотность по воздуху: М = 29 · Dвозд, где 29 — средняя молекулярная масса воздуха. Таким образом, экспериментальное определение молекулярной массы этим способом сводится к определению относительной плотности данного вещества по водороду, воздуху или другому стандартному газу. Например, масса 1 л азота при н.у. равна 1,25 г, а масса 1 л водорода – 0,09 г. Следовательно относительная плотность азота по водороду: Dн2 = 1,25/0,09 = 14, откуда Mr N2 = 2 * 14 = 28. Определить молярную массу, а, следовательно, и относительную молекулярную массу газа можно, используя уравнение Менделеева-Клапейрона: pV = mRT/M, (6) где V – объем газа при данных условиях, л; р – атмосферное давление, кПа; Т – абсолютная температура, К; R – универсальная газовая постоянная, 8,31 Дж/(моль*К).
2. Можно дать несколько определений понятия эквивалента. Например, для кислотно-основных реакций эквивалент (Э) соответствует количеству вещества, взаимодействующему с 1 г атомов водорода или замещающему 1 г атомов водорода в химических реакциях. Э(Н) = 1. Более широкое определение: Эквивалент (Э) -это реальная или условная единица, соответствующая одному иону водорода в кислотно-основных или ионных реакциях или одному электрону в окислительно-восстановительных реакциях (безразмерная величина). Моль эквивалентов (nэ)– количество вещества, содержащее 6,02 . 1023 эквивалентов (моль (экв)). Фактор эквивалентности – величина обратная числу новых химических связей, устанавливаемых одной частицей вещества в ходе химической реакции (определяет, какая часть моля данного вещества взаимодействует с 1 г атомов Н или с 1 моль(экв) любого другого вещества). Молярная масса эквивалентов (Мэ) – масса одного моля эквивалентов (г/моль(экв)). Молярный объем эквивалентов (Vэ) – объем одного моля эквивалентов (л/моль(экв)). Для расчета молярной массы эквивалентов используют следующие формулы: - Мэ простого вещества –отношение молярной массы атомов вещества (А) к валентности (В): Мэ = А/В; - Мэ элемента– отношение молярной массы атомов элемента к валентности: Мэ = А/В; Мэ (кислоты) –отношение молярной массы вещества к основности: Мэ = М/nатомов Н; Мэ (основания) –отношение молярной массы вещества к кислотности: Мэ = М/nОН-групп. При этом нужно помнить, что при образовании кислых или основных солей в химических реакциях проявляемая основность кислоты или кислотность основания равна, соответственно, числу атомов Н или числу ОН-групп, замещенных в ходе реакции. Мэ (соли) –отношение молярной массы вещества к произведению валентности металла на число его атомов: Мэ = М/(Ватомов Ме *nатомов Ме). В окислительно-восстановительных реакциях: Мэ окислителя или восстановителя –отношение молярной массы окислителя или восстановителя к числу приобретенных или потерянных одной молекулой вещества электронов в ходе реакции, соответственно. Закон эквивалентов:Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам: m1/ m2 = Мэ1/ Мэ2 или m1/ Мэ1 = m2 / Мэ2, Для газообразных веществ: V1/Vэ1 = V2/Vэ2 Из закона эквивалентов следует, что количества моль эквивалентов (nэ) каждого из взаимодействующих и образующихся в реакции веществ, равны, так как nэ = m/ Мэ или для газообразных веществ: nэ = V/Vэ При расчетах по закону эквивалентов составлять уравнения реакций не требуется.
ПРАКТИЧЕСКАЯ ЧАСТЬ Цель работы:Определить молекулярную массу углекислого газа, определить молярную массу эквивалента цинка, магния или алюминия (по указанию преподавателя).
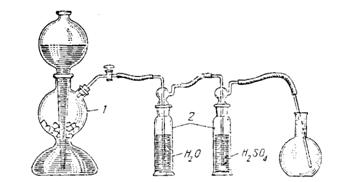
Оборудование и материалы:весы; аппарат Киппа; склянки Дрекселя; колба плоскодонная вместимостью 1л с пробкой; цилиндры емкостью 500 и 1000 мл; воронки стеклянные; установка для определения Мэ; сушильный шкаф; бюксы. Реактивы:мрамор; конц. серная кислота; 1-2 н. раствор соляной кислоты; вода дист., цинк мет.; магний мет.; алюминий мет.; растворысоляной кислоты (5%-ный, 15%-ный; 1 М). Ход работы Опыт 1. Определение молекулярной массы углекислого газа Определение молекулярной массы углекислого газа производится при помощи установки, изображенной на рис. 3.1.
Углекислый газ, полученный при действии соляной кислоты на мрамор, из аппарата Киппа проходит через промывные склянки, наполненные водой и серной кислотой. В первой склянке он освобождается от хлористого водорода (из аппарата Киппа), во второй - высушивается. Очищенным и сухим газом наполняют колбу, которую затем взвешивают. Зная вес газа, его объем, температуру и давление, можно вычислить его молекулярную массу. Определение проводят следующим образом: 1. Взвесить колбу, закрытую резиновой пробкой; положение нижнего края пробки отметить специальным карандашом для надписей по стеклу. 2. Заполнить колбу углекислым газом для чего, трубку прибора опустить в колбу до дна, открыть кран аппарата Киппа и пропускать газ в колбу в течение 6 - 8 мин. Для постепенного заполнения колбы газом и его достаточной очистки необходимо установить такую скорость прохождения газа через промывные склянки, при которой можно считать пузырьки. Если газ будет поступать в колбу сильной струей, то это не только ухудшит очистку СО2 от примесей, но и вызовет образование завихрений, в результате чего не будет происходить полного вытеснения воздуха. 3. После наполнения колбы СО2 ее закрыть пробкой до метки и взвесить. 4.Чтобы быть уверенным в том, что колба заполнена углекислым газом, еще раз в течение 5 мин пропускать газ в колбу. Затем ее снова взвесить. Если результаты двух взвешиваний колбы с углекислым газом одинаковы, то наполнение и взвешивание прекратить. Если же наблюдается различие в массе, то указанную операцию повторить до получения постоянной массы. 5. Записать показания барометра и термометра, находящихся в лаборатории. 6. Определить объем углекислого газа при данных условиях; для этого в колбу налить воду до черты, отмеченной на горле колбы, и затем измерить объем воды цилиндром. Объем воды равен объему углекислого газа.
|
||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 686. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
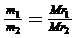 (2)
(2)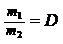 (3)
(3)