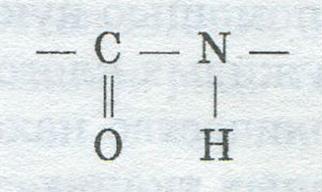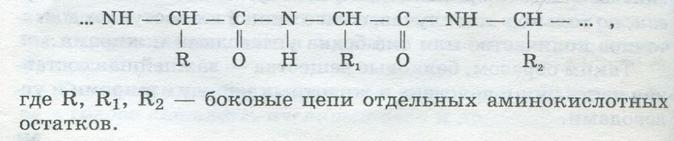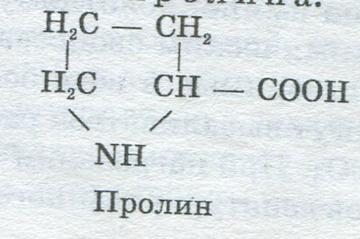Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Значение белков в питании и содержание их в пищевых продуктахБелковые вещества, или белки, представляют собой природные высокомолекулярные азотсодержащие органические соединения, очень сложные молекулы которых построены из остатков α-аминокислот. Значение белков в природе исключительно велико, поскольку они играют первостепенную роль во всех явлениях жизни. «Жизнь есть способ существования белковых тел». Белки широко распространены в природе. Особенно много их содержится в организме животных и человека. В растениях их количество значительно меньше. В то же время только в растениях наряду с синтезом углеводов осуществляется синтез белков из СО2, минеральных азотсодержащих соединений и воды. В животные организмы белки поступают в готовом виде — с растительной и животной пищей. В процессе пищеварения под влиянием ферментов они расщепляются до α-аминокислот, которые усваиваются организмом и расходуются на синтез необходимых (специфичных) для данного организма белков с помощью нуклеиновых кислот. Протоплазма и ядра живых клеток состоят в основном из белков. Большое их количество находится также в костях, хрящах, мышцах, нервных тканях, волосах, чешуе рыб, рогах, ферментах и т.д. Помимо участия в построении тканей и синтезе веществ организма, белки служат источником энергии но только в том случае, если с пищей их поступает достаточное количество или она бедна углеводами и жирами. Таким образом, белковые вещества — важнейшая составная часть пищи человека и животных наряду с жирами и углеводами. Оптимальная суточная норма белка для взрослого человка составляет 100—120 г. Правильным считается соотношение в пище белков, жиров и углеводов 1:1:4. Среднее содержание белков в пищевых продуктах следующее: в сое — 33—44 %, икре рыб — 26, сыре — 18—25, горохе — 22,4, твороге обезжиренном — 17,5, мясе — 14—21, рыбе — 13—18, яйцах — 12,5, пшенице — 10—18, ржи — 11, хлебе пшеничном — 6,8—7,8, молоке — 3, плодах и ягодах - 0,2—1,5, овощах — 0,5—6,5, картофеле — 2,0, масле сливочном — 0,5, дрожжах кормовых — 45—50 %. В белках дрожжей в достаточном количестве находятся незаменимые кислоты, что подтверждает их большую питательную ценность. По элементарному составу белки незначительно отлипаются один от другого. Содержание в них углерода составляет 50,6—54 %, кислорода — 21,5—23,5, водорода — 6,5—7,3, азота — 15—18,4, серы — 0,3—2,5 %. В состав молекул некоторых белков входят железо, йод, фосфор, медь, кальций, магний.  Свойства белков Специфические свойства и пищевая ценность различных белков определяются их строением и аминокислотным составом. Основу молекул белков составляет одна, несколько или большое количество полипептидных цепей, каждая из которых, в свою очередь, складывается из многих десятков и сотен остатков аминокислот, соединенных прочной (ковалентной) пептидной связью:
Последняя образуется при взаимодействии карбоксильной группы одной аминокислоты с аминогруппой другой:
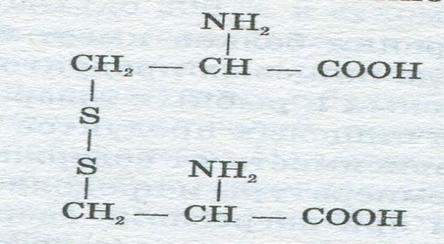
Последовательность аминокислот, соединенных друг с другом пептидными связями, характеризует первичную структуру белка. Молекулярная масса белков колеблется от 6000 до 1 млн и более. Белок с М = 6000 содержит - 51 аминокислотный остаток. Молекулы некоторых белков состоят из одного или нескольких полипептидов. Соединяясь друг с другом, полидептидные цепи в результате образования различных связей образуют вторичную структуру белка, обычно в форме спирали. Она образуется за счет водородных связей между кислородом и водородом. Спирали и нити вторичной структуры, а также неупорядоченные участки полипептидных цепей могут складываться, образуя своеобразные клубки, таким образом создается третичная структура белка. Она характеризуется внутримолекулярными взаимодействиями различного типа. При этом могут возникать водородные, а также дисульфидные связи –СН2—S—S—СН2—, вандервальсовские силы между боковыми радикалами аминокислот. Несколько «клубков» третичной структуры в некоторых белках ассоциируются, образуя еще более сложную четвертичную структуру белка. В зависимости от укладки пептидных цепей в молекулах различают белки глобулярные и фибриллярные. Белки, имеющие форму сильно скрученной, сферической и эллиптической спирали, называются глобулярными. Они находятся в молоке, сыворотке крови, тканях животных; растворяются в воде и слабых растворах. Белки в виде развернутой спирали, нитевидные, волокнистые носят название фибриллярных. Они встречаются в мышцах, сухожилиях; в большинстве случаев не растворяются в воде. К фибриллярным белкам относятся коллаген, желатин, кератин, миозин, к глобулярным — альбумины, глобулины. Белки являются аморфными веществами, представляющими собой высокомолекулярные коллоиды, но некоторые из них удалось выделить из растворов в кристаллическом виде: яичный и молочный альбумин, казеин, гемоглобин н др. Однако кристаллы этих белков отличаются от обычных кристаллов, они способны набухать и удерживать воду и примеси, т.е. ведут себя как коллоиды. Одним из важнейших свойств белков является их способность к набуханию. Безводный сухой белок поглощает большое количество воды (до 300 % к сухому весу). Это явление называется набуханием геля. В гелях вода окружает частицы коллоидов и находится в капиллярных пространства между ними, прочно связываясь с белком. Набухание белков зависит от рН, присутствия солей, снижающих обычно способность белка к набуханию. Наименьшей способностью к набуханию белки обладают в изоэлектрической точке, когда величина рН среды такова, что электрический заряд частиц белка равен нулю. Процесс набухания белков имеет большое значение при переработке пищевых продуктов и их использовании — при замесе теста, приготовлении макарон и т.д. Во время хранения продуктов происходит старение белков. По мере старения белок постепенно теряет способность к набуханию, снижается его растворимость и способность к гидролизу. Старение белков проявляется при длительном хранении богатых белками продуктов (например, бобовых). В результате старения продукты приобретают жесткую консистенцию, плохо развариваются и усваиваются. При старении набухшего белка происходит отделение воды от набухаюшего геля — синерезис. Структуры белков лабильны: под влиянием тех или иных факторов (нагревания, химических реактивов и др.) в макромолекулах белков изменяются вторичные, третичные и четвертичные структуры, причем пептидные и дисульфидньи связи могут оставаться без изменений. В результате этого появляется новый белок, отличающийся от природного физико-химическими и биологическими свойствами. Так, при нагревании растворов белков до 70—100 °С, белка казеина - свыше 100 °С, а также при воздействии на белок сильных кислот и щелочей, солей тяжелых металлов (свинец, медь), ионизирующей радиации, ультрафиолетовых лучей, ультразвуковых волн происходит денатурация — необратимая коагуляция с нарушением вторичной, третичной и четвертичной структур белка. При денатурации белков снижается их способность вновь растворяться в воде и солевых растворах. При тепловой денатурации глобулярных белков вязкость их повышается, при этом глобулы выпрямляются и приобретают нитевидную форму. Вязкость фибриллярных белков, наоборот. уменьшается, так как происходит скручивание пептидных цепей. Тепловая денатурация белков имеет большое значение и производстве ряда пищевых продуктов — выпечке хлеба изготовлении мясных и рыбных товаров и т.д. Скорость денатуляции белков пищевых продуктов при обработке находится в прямой зависимости от содержания в них воды и кислот, а также от температуры и продолжительности нагревания. Не все белки при нагревании свертываются, например коллаген при нагревании в воде растворяется, превращаясь в желатин. Денатурация белков наблюдается и при длительном хранении некоторых продуктов, например семян бобовых, в которых белки по мере старения теряют способность к набуханию. Не связанным с денатурацией процессом является высаливание белков, заключающееся в том, что при добавлении к раствору белка концентрированных растворов солей достигается изоэлектрическое состояние, и белок выпадает в осадок, но не подвергается денатурации и может быть растворен. В этом случае он не изменяет своих свойств. Классификация белков Все белки разделяются на две группы: простые — протеины и сложные — протеиды. Протеины — это простые белки, которые отличаются тем, что в их состав входят лишь остатки α-аминокислот. К простым белкам относятся важнейшие белковые вещества пищи: альбумины, глобулины, глютелины, проламины, фосфопротеины, протамины, гистоны и, наконец, протеиноиды. Классификация простых белков обусловлена в основном характером их растворимости. Однако следует помнить, что белки, входящие по этому признаку в одну группу, могут быть не идентичны по аминокислотному составу, пищевой ценности и физико-химическим свойствам. Альбумины — растворимые в воде белки, дающие нейтральную реакцию; могут высаливаться растворами нейтральных солей — (NН4)2SO4. При нагревании свертываются и выпадают в виде сгустков денатурированного белка. Многие альбумины могут быть получены в кристаллическом виде. Альбумины содержат в своем составе аминокислоту цистин :
По этой причине они являются самыми богатыми серой (до 2,3 %) белками. Сравнительно много альбуминов в куриных яйцах (овоальбумин), мясе (миоальбумин). Содержатся они также в молоке (лактоальбумин). В большинстве хлебных изделий альбумины, например л е й к о з и н , в продуктах, полученных из пшеницы, находятся в небольшом количестве. Богаты альбуминами гречиха и зерно бобовых культур. Сравнительно много их во ржи и овсе. Глобулины — белки, не растворимые в воде, но раствори мые в водных растворах нейтральных солей. Обычно для растворения глобулинов применяют 10 % раствор NаС1 или 5 % раствор К2SО4. Глобулины почти всегда сопутствуют альбуминам. Глобулины широко распространены, особенно в растительном мире. Растительные глобулины отличаются от животных высоким содержанием азота (16—19 %) и тем, что они труднее свертываются и высаливаются. Представителями животных глобулинов являются: миозиноген — важнейший белок мышц, фибриноген крови, туберин — глобулин картофеля. Проламины — белки, не растворимые в воде и в растворах нейтральных солей, но растворимые в 60—80 % этиловом спирте. Свое название они получили из-за большого содержания аминокислоты пролина:
Проламины составляют значительную часть белков хлебах товаров. К ним относятся г л и а д и н пшеницы и ржи, зеин кукурузы, г о р д е и н ячменя и др. Глютелины — белки, растворимые в слабых (0,2 %) растворах щелочей. Как и проламины, они содержатся в большинстве продуктов растительного происхождения. К ним относятся г л ю т е н и н ы пшеницы и ржи, о р е з е н и н риса а также г л ю т е л и н ы кукурузы, ячменя, овса и т.д. В пшеничной муке глютенин (глютелин) вместе с глиадином (проламином) в процессе набухания образуют связную массу— клейковину , имеющую большое значение в хлебопечении. фосфопротпеины характерны тем, что в их состав входит остаток фосфорной кислоты, связанный с белком эфирной связью. Эти соединения, содержащие остаток фосфорной кислоты, по химическому составу относятся к протеидам, но в связи с тем, что по свойствам они близки к простым белкам, их рассматривают в группе протеинов. Фосфопротеины играют важную роль в питании зародышей животного, а также молодого растущего организма. К фосфопротеинам относятся казеин молока, в и т е л л и н яичного желтка и и х т у л и н , содержащийся в икре рыб. Протамины и гистоны имеют сравнительно с другими белками небольшую молекулярную массу. Они состоят главным образом из диаминокислот, а поэтому имеют сильно выраженный основной характер. Гистоны по сравнению с протаминами имеют более слабый основной характер, в отличие от последних они содержат серу и способны осаждаться от небольших количеств аммиака. Протамины и гистоны встречаются в сперме рыб, гистоны в виде белка глобина входят в состав гемоглобина крови. Протеиноиды — не растворимые в воде, слабых кислотах и щелочах фибриллярные белки, широко распространенные только в животных организмах, где они образуют клеточные оболочки, соединительные ткани, хрящи и др. Для них характерно высокое содержание серы. К протеиноидам относятся кератин, коллаген, эластин, хитин. Кератин содержится в клетках эпидермиса, волос, ногтей, у животных — в рогах, копытах, поверхностном слое кожи. Он не изменяется при кипячении в воде и почти не расщепляется ферментами. К о л л а г е н также содержится в клетках эпидермиса волос, ногтей, входит в состав костной и хрящевой тканей. В отличие от кератина он гидролизуется под влиянием ферментов и при кипячении с водой переходит в глютин клей, желатин. Э л а с т и н входит в состав сухожилий и соединительной ткани. Х и т и н образует панцири насекомых и раков. Протеиды — сложные белки, которые представляют собой соединения простого белка с другим веществом небелкового характера, называемым простетической группой. Протеиды находятся в продуктах питания в меньшем количестве, чем протеины, но многие из них имеют большое значение в жизнедеятельности организма и являются ценными в питании. Все протеиды осаждаются спиртом. В зависимости от химической природы простетической группы различают: нуклеопротеиды, глюкопротеиды, липопротеиды, хромопротеиды. Нуклеопротеиды — соединения белков (чаще всего гистонов и протаминов) с нуклеиновыми кислотами, которые находятся в растительных и животных клетках. Нуклеопротеиды играют первостепенную роль в жизнедеятельности организма (ДНК, РНК). Много нуклеопротеидов находится в зародышах семян злаковых растений — пшеницы, ржи и др. Глюкопротеиды — сложные белки, белковые вещества которых соединены с глюкозой или другими сахарами. При их гидролизе кроме аминокислот и углеводов нередко выделяются серная и уксусная кислоты. Глюкопротеиды муцины и мукоиды находятся в слизистых выделениях животных, костях, хрящах, в составе пищеварительных жидкостей. Они трудно поддаются действию ферментов, расщепляющих белки, обволакивают слизистую оболочку пищеварительного тракта и облегчают прохождение пищи, покрывают поверхность тела некоторых животных и входят в состав слюны. Липопротеиды — соединения белка с жирами или липоидами, растворимые в воде, нерастворимые в органических растворителях (эфире, бензоле, хлороформе). Они находятся в яичном желтке, плазме животных клеток, нервной ткани, содержатся в большом количестве в составе пластид растительной клетки. Хромопротеиды — сложные белки, которые включают шейные простетические группы, содержащие железо, магний, медь. К хромопротеидам, содержащим железо, относятся гемоглобин крови, миоглобин мышц (эти белки связывают и переносят кислород тканям), окислительные ферменты- каталаза и пероксидаза . Магнийсодержащим хромопротеидом является хлорофилл растений. В крови моллюсков, ракообразных находятся медьсодержащие хромопротеиды — гемоцианины , которые переносят кислород (с присоединением кислорода они окрашиваются в голубой цвет). |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 617. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |